Зависимость теплового эффекта химической реакции от температуры
Определение теплоемкости: в общем случае можно дать определение истинной теплоемкости как отношение между бесконечно малым количеством тепла, переданному системе, и изменением температуры, которое его вызвало:
C = 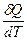 .
.
Из первого закона термодинамики, учитывая, что Q для изохорного процесса равно U:
CV = (dU/dT)V
Соответственно, для изобарного процесса: CP = (dH/dT)P
Дифференцируя уравнение по температуре: DU = U2 - U1, получаем:
[ 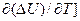 V = (
V = ( 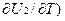 V - (
V - ( 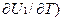 V = CV2 – CV1 =DCV,
V = CV2 – CV1 =DCV,
где:
CV1 и CV2 - теплоемкости при постоянном объеме системы в первоначальном и конечном состояниях соответственно.
DCV - изменение теплоемкости при постоянном объеме при переходе из состояния 1 в состояние 2.
DCV = å(nCV)прoд - å(nCV)рeaг
Для процесса при постоянном давлении, аналогично: [ 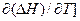 P = DCP
P = DCP
Эти уравнения являются математическими выражениями Закона Кирхгофа, который можно сформулировать следующим образом: температурный коэффициент теплового эффекта процесса равен изменению теплоемкости системы, происходящему в результате процесса.
Закон Кирхгофа в интегральной форме:
DHT2 =DHT1 + 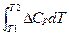 (при P = const)
(при P = const)
DUT2 =DUT1 + 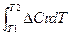 (при V = const)
(при V = const)
Дата добавления: 2015-11-04; просмотров: 821;
