Влияние температуры на скорость реакции
Для средних температур, долгое время использовалось приближенное правило Вант-Гоффа: скорость реакции возрастает приблизительно от 2 до 4-х раз при возрастании температуры на каждые 10o.
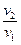 =
= 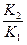 = g
= g 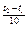
g - температурный коэффициент скорости реакции
Уравнение Аррениуса (1889)
Математическое выражение уравнения Aррениуса:
K= A×e 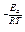
Ea - энергия активации - это то избыточное количество энергии (по сравнению со средней величиной), которым должна обладать молекула в момент столкновения, чтобы быть способной к данному химическому взаимодействию.
A - константа, характеризующая данную реакцию.
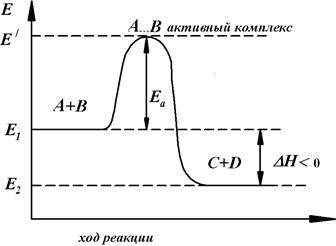
Энергия молекулярной системы - отложена на оси ординат, ход реакции - на оси абсцисс. Если прямая реакция, то есть переход из состояния I (исходные вещества А и В) в состояние II (конечные продукты С и D) - экзотермическая, общая энергия продуктов реакции Е2 меньше, чем общая энергия реагентов Е1, т.e. в результате реакции система переходит на более низкий энергетический уровень (с уровня I на уровень II). Разность между уровнями энергии равна тепловому эффекту реакции (DН, или если упростить DН=DU) уровень Е' определяет наименьшее количество энергии, которое должна иметь молекулы в момент столкновения, чтобы в результате произошла химическая реакция. Разность между уровнем Е' и уровнем I - энергия активации прямой реакции E1 и разность между уровнем Е' и уровнем II - энергия активации обратной реакции E2. Таким образом, на пути от реагентов до конечных продуктов реакции, система должна преодолеть своего рода энергетический барьер.
Цепные реакции
Особенностью цепных реакций является то, активирование одной частицы каким-либо образом приводит к реакции не только данной частицы, но последовательно большому количеству таких активированных частиц.
В цепных реакциях вначале молекулы реагируют с активными частицами (свободными атомами и радикалами с ненасыщенной валентностью, ионами, молекулами в возбужденном состоянии и.т.п.) далее, проходя через серию промежуточных стадий, в результате образуют конечные продукты и такого же рода активные частицы. Последние, взаимодействуя с новыми молекулами начальных веществ, обеспечивают дальнейший ход реакции.
Начало такой цепи, т.e. образование активных частиц может проходить различными путями.
Например, кинетика реакции между газообразными бромом и водородом может быть выражена простым химическим уравнением:
H2 + Br2 = 2 HBr
Кинетика реакции была исследована M.Боденштейном. Как только реакция была инициирована тем или другим способом, она продолжалась дальше в некоторой степени до самопроизвольно. Это происходит благодаря серии реакций, происходящих частично параллельно, частично - последовательно.
Механизм реакции может быть описан следующим образом:
Br2 ® Br· + Br· начало реакции
Br· + H2 ® HBr + H· цепь реакций
H· + Br2® HBr + Br·
Br· + H2 ® HBr + H·
Br· + Br· ® Br2 обрыв цепи
Одна из наиболее важных особенностей цепных реакций, значительно влияющих на их скорость - это длина цепи, т.e. число молекул данных веществ, вступающих в реакцию в результате единичного акта начала инициирования цепи.
Кроме того, участвуя в основной реакции, активные частицы могут также расходоваться на побочные реакции, в числе которых - столкновения со стенкой сосуда или молекулами инертных веществ, присутствующих в сосуде. В результате таких столкновений активные молекулы теряют избыток энергии и становятся неактивными; происходит так называемый обрыв цепи. Таким образом, для цепных реакций форма сосуда может быть очень важным фактором.
Обрыв цепи также происходит из-за присутствия в сосуде инертных материалов, даже частиц пыли. Цепные реакции очень чувствительны к изменению концентраций и реагентов и посторонних газов. Цепные реакции явл. очень распространенными, в частн. цепным механизмом обусловлены особенности процесса сгорания топлива в двигателях внутреннего сгорания.
Существуют цепные реакции, в которых одна активная молекула может привести к образованию 2-х или более активных молекул. В таком случае скорость реакции быстро возрастает и обычно реакция заканчивается взрывом. Такие реакции называют реакциями с разветвленными цепями:
Дата добавления: 2015-11-04; просмотров: 1170;
