I. Реакции радикального замещения (SR).
1. Галогенирование. Алканы реагируют с галогенами с образованием моно- и поли галогеналканов. Реакция протекает по цепному свободнорадикальному механизму.
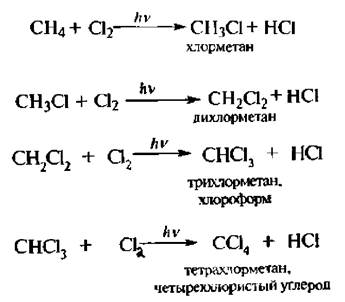
При взаимодействии метана с хлором, протекающем при освещении или нагревании, происходит постепенное замещение атомов водорода атомами хлора:
Механизм данной реакции был изучен академиком, лауреатом Нобелевской и Государственной премии СССР Н.Н. Семеновым.
В цепной реакции выделяют три последовательные стадии: инициирование, рост цепи и обрыв цепи.
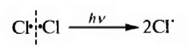
Инициирование. Молекула галогена под действием квантов света (hv) или нагревании претерпевает гемолитический разрыв связи с образованием свободных радикалов:
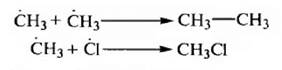
Рост цепи. Образовавшиеся свободные радикалы хлора атакуют связь С-Н в молекуле СН4, отрывают атом водорода с образованием НСl и свободного метильного радикала СН3.

Метильный радикал атакует молекулу хлора, отрывает атом галогена и образует хлорметан СН3С1 и свободный радикал хлора:

Образовавшийся радикал Cl повторяет цикл указанных превращений, т. е. происходит цепная реакция, в которой атом хлора, прореагировавший на предыдущей стадии роста цепи, способствует высвобождению нового радикала хлора на последующей стадии. Образуется смесь моно-, ли-, три- и тетрахлорпроизводных метана.
Цепная реакция завершается только после исчезновения всех образовавшихся входе превращений свободных радикалов.
Обрыв цепи происходит в результате рекомбинации (димеризации) свободных радикалов.
Следует обратить внимание на региоселактивность (избирательность) галогенирования (особенно бромирования) алканов. В первую очередь замещается атом водорода при третичном углеродном атоме, затем – при вторичном и в последнюю очередь – при первичном.
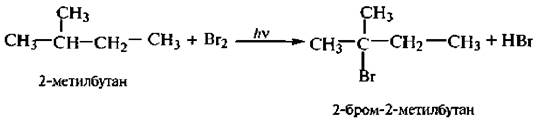
Такую последовательность замещения определяет устойчивость образующихся свободных радикалов. Региоселективность галогенирования алканов возрастает при понижении температуры реакции. Чем активнее галогенирующий реагент, тем ниже избирательность процесса,
2. Нитрование алканов проводят разбавленной азотной кислотой при нагревании и повышенном давлении (реакция Коновалова):
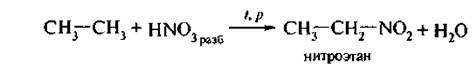
Механизм SR:
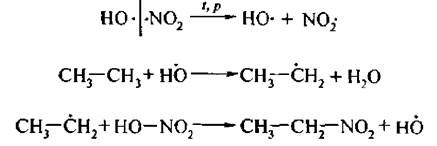
Следует отметить, что алканы в обычных условиях не взаимодействуют с концентрированной азотной кислотой,
3. Судьфохлорирование. Алканы при совместном действии оксида серы (IV) и хлора в условиях УФ-облучения образуют алкансульфонилхлорилы R-SO2Cl.
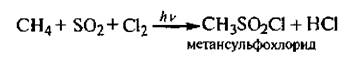
Реакция протекает по свободнорадикальному механизму (SR):
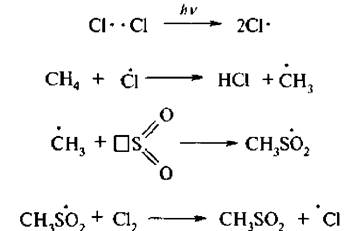
Сульфохлорирование алканов позволяет получить смесь первичных и вторичных алкансульфохлоридов. Третичные алкансульфохлориды в силу пространственных препятствий не образуются.
II. Окисление. Алканы в избытке кислорода или на воздухе горят с выделением большого количества теплоты:
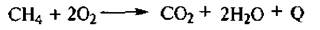
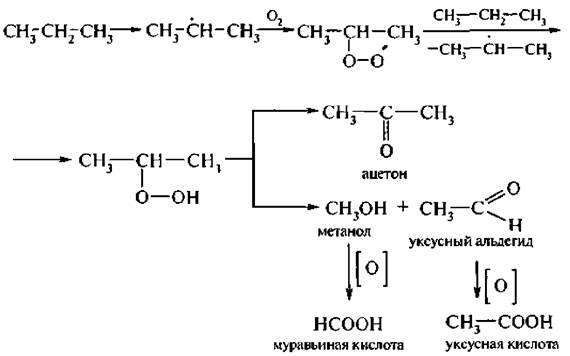
Окисление алканов в присутствии катализатора (соли марганца, хрома и др.) и при нагревании (150–200 °С) протекает по радикальному механизму и сопровождается разрывом С-С связей.
III. Крекинг алканов – это процесс термического расщепления алканов.
Термический крекинг проводят при t = 800 °С и выше, каталитический – при t = 450...550 °С в присутствии алюмосиликатных катализаторов.
Высшие алканы в условиях термического крекинга образуют смесь низших алканов и алкенов.
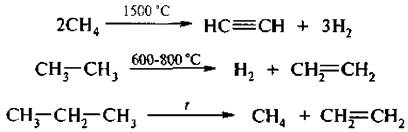
Крекинг-процесс имеет важное промышленное значение: получение высокооктановых бензинов, непредельных и ароматических углеводородов.
7. ЦИКЛОАЛКАНЫ
Цнклоалканами называют алициклические углеводороды, в которых углеродные атомы, образующие цикл, находятся в sp3-гибрндизации.
Классификация циклоалканов
Циклоалканы классифицируют по величине цикла, числу циклов и способу соединения циклов в молекуле. По величине цикла различают:
• циклоалканы с малыми циклами (трех- и четырехчленные);
• циклоалканы с обычными циклами (пяти-, шести- и семичленные);
• циклоалканы со средними циклами (от восьми- до одиннадцати членных);
• макроциклы (двенадцатичленные и более».
В зависимости от числа циклов в молекуле выделяют:
• моноциклические;
• бициклические;
• полициклические.
Бициклические циклоалканы по способу соединения циклов подразделяют на 3 группы:
спираны (два кольца имеют один общий атом углерода);
конденсированные (два кольца имеют два общих соседних атома углерода);
мостиковые (два кольца имеют три и более общих атомов углерода).
Дата добавления: 2015-09-29; просмотров: 21269;
