Номенклатура
Простейшим представителем углеводородов ряда этилена является сам этилен, или этен: С2Н4, Н2С=СН2. Названия алкенов по заместительной номенклатуре И ЮПАК образуются путем замещения суффикса -ан в названии предельного углеводорода на -ен, положение двойной связи указывается цифрой, при этом нумерация начинается с того конца цепи, к которому ближе расположена двойная связь:
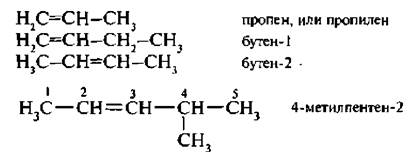
Для низших членов гомологического ряда алкенов более употребимы тривиальные названия – этилен, пропилен, для остальных членов гомологического ряда применяют заместительную номенклатуру.
Иногда используют рациональную номенклатуру. По этой номенклатуре углеводород рассматривают как производное этилена, в котором атомы водорода замещены на радикалы.
Например:
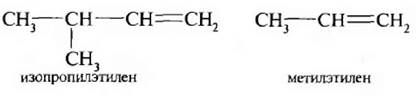
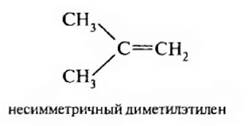
Если в молекуле этилена два атома водорода замещены на радикалы, то алкены рассматривают как симметричные или несимметричные.
Название одновалентных радикалов этого ряда углеводородов получают добавлением к названию алкена суффикса -ил, атом углерода со свободной валентностью должен иметь наименьший номер, например:
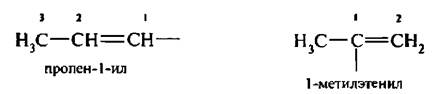
Для некоторых радикалов используются тривиальные названия:

Изомерия
Для алкенов характерна изомерия углеродного скелета, изомерия положения двойной связи и геометрическая (цис-, транс-) изомерия;
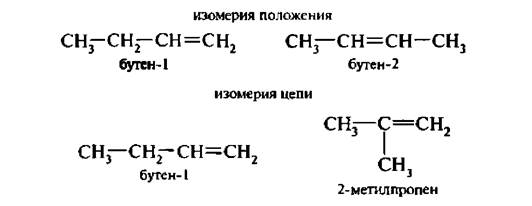
Бутен-2 существует в виде двух пространственных изомеров:

Если у атомов углерода, связанных двойной связью, имеется три или четыре разных заместителя, используют Е, Z-систему обозначении конфигурации геометрических изомеров.
Способы получения
1. Природные источники (нефть, природный газ).
2. Крекинг высших алканов, то есть термическое разложение предельных углеводородов с образованием низкомолекулярных предельных и непредельных соединений.
3. Дегидратация предельных одноатомных спиртое. Алкены легко могут быть получены дегидратацией спиртов. В лабораторных условиях в качестве водоотнимающего средства обычно используют серную или фосфорную кислоту.
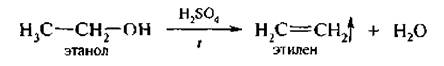
В промышленности применяют оксид алюминия. Пары пропилового спирта пропускают над катализатором при температуре 300–400 *С
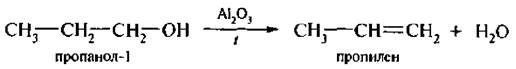
Реакция протекает на границе раздела между твердой фазой и газообразной (гетерогенный катализ).
Отщетение воды от спирта с разветвленной структурой подчиняется правилу А. Зайцева (1875 г.): приобразовании молекулы воды водород отщепляется от наименее гидрогенизированного атома углерода, находящегося в β-положении по отношению кОН-группе.
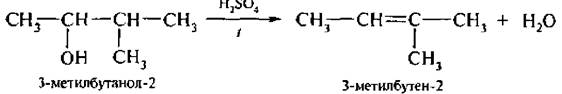
4. Отщепление галогеноводородов от галогеналканов. При действии спиртового раствора щелочи на моногалогенопроизводные отщепляется галогеноводород и образуются алкены.
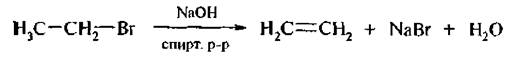
5. Дегалогенирование дигалогеналканов. Вицинальные дигалогеналканы (с атомами галогена у соседних атомов углерода) при нагревании c Zn или Mg в водноспиртовом растворе отщепляют два атома галогена, образуя алкены:

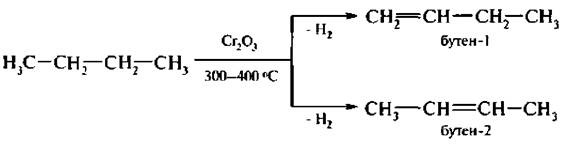
6. Дегидрирование алканов. Это промышленный метод получения алкенов. Реакцию проводят при температуре не выше 600 °С во избежание разрыва С-С связей (крекинг). В качестве катализатора используют мелкораздробленный никель, оксид хрома (III) Сr2O3 и др.
Физические свойства
Первые представители гомологического ряда алкенов (С2–С4) – это газы, дальше – (C5–С17) жидкости и твердые вешества. С увеличением молекулярной массы увеличивается их температура плавления, температура кипения, удельный вес
Алкены с нормальным строением кипят при более высокой температуре, чем их разветвленные изомеры. Температура кипения цис-изомеров выше, чем транс-изомеров, а температура плавления – наоборот.
Алкены практически нерастворимы в воде, сами являются хорошими растворителями. Они горят более коптящим пламенем, чем алканы, что объясняется большим процентом содержания углерода.
Химические свойства
Химические свойства алкенов обусловлены наличием двойной С=С-связи (углерод-углеродной).
Двойная связь 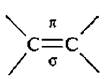 значительно короче (0,134 нм) простой σ-связи и прочнее. Энергия этой связи 611 кДж/моль, на разрыв σ-связи приходится 339,6 кДж/моль. тогда энергия разрыва л-связи будет равна: 611 – 339 = 272 кДж/моль, то есть энергия π-связи невелика. Этим объясняется легкость, с которой непредельные углеводороды вступают в реакции присоединения.
значительно короче (0,134 нм) простой σ-связи и прочнее. Энергия этой связи 611 кДж/моль, на разрыв σ-связи приходится 339,6 кДж/моль. тогда энергия разрыва л-связи будет равна: 611 – 339 = 272 кДж/моль, то есть энергия π-связи невелика. Этим объясняется легкость, с которой непредельные углеводороды вступают в реакции присоединения.
В свою очередь двойная связь влияет на реакционную способность связей С–Н у соседнего с ней sp3-гибридизированного атома углерода (α-атом) (благодаря σ,π-сопряжению). Атомы водорода приобретают подвижность и способность вступать в реакции замещения (SR).
Для алкенов характерны также реакции окисления, восстановления и полимеризации.
1. Гидрогенизация (гидрирование) – присоединение водорода протекает в присутствии катализаторов (тонкоизмельченных Pt, Pd или Ni).
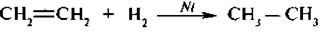
2. Присоединение галогенов (галогенирование). Алкены легко присоединяют хлор и бром, труднее – йод, в результате образуются вицинальные дигалогенопроизводные алканов.
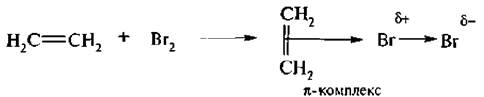
Электронодефицитный атом брома забирает пару электронов π-связи на образование σ-связи с атомом углерода, в результате образуется σ-комплекс:
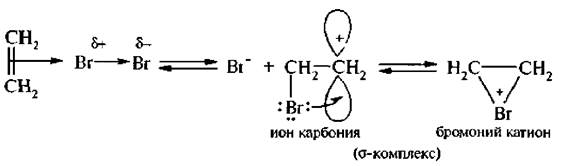
σ-Комплекс представляет собой равновесную систему, состоящую из карбкатиона и бромоний-иона.
Взаимодействие σ-комплекса с бромид-ионом происходит стерео-селективно, то есть бромид-ион атакует σ-комплекс с противоположной стороны от имеющегося галогена. Такое присоединение называется транс-присоединением.
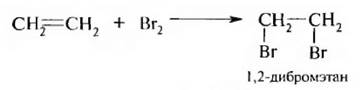
Присоединение происходит по элекгрофильному механизму – АЕ (присоединение электрофильное). Под влиянием π-электронной плотности двойной связи молекула брома поляризуется, при этом образуется π-комплекс:
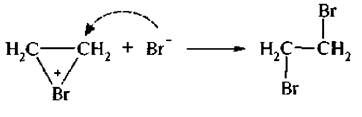
Эта реакция имеет аналитическое значение для качественного и количественного определения соединений, содержащих двойную углерод-углеродную связь.
Направление реакции галогенирования может изменяться в зависимости от условий реакции. Так, алкены с галогенирующими реагентами (хлором, N-бромсукцин имидом) в присутствии инициаторов процесса образования свободных радикалов (пероксиды, температура, УФ-свет) вступают в реакцию свободнорадикального замещения. При этом атом водорода у атома углерода в α-положении к двойной связи замещается на галоген. Такое замещение получило название аллильного.
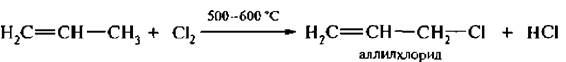
Реакция идет через образование аллильных радикалов

которые являются более устойчивыми по сравнению с обычными алкильными.
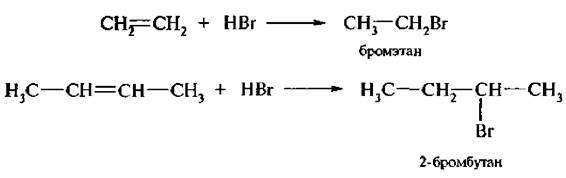
3. Присоединение галогеноводородов (гидрогалогенирование). Алкены вступают в реакцию присоединения со всеми галогеноводородами, В случае этилена или симметричных алкенов образуется один продукт реакции независимо оттого, к какому атому углерода присоединяется водород или галоген:
Если галогеноводород присоединяется к несимметричному алкену, то во время реакции могут образоваться два продукта, например:
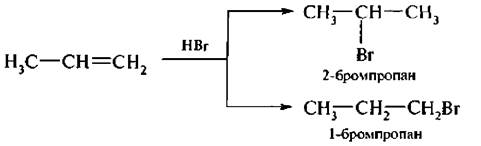
В 1869 г, русский химик В. В. Марковников на основании экспериментальных данных установил закономерность в присоединении галогеноводородов и родственных им соединений к несимметричным алкенам, известную под названием правила Марковникова. Его сущность в следующем:
прн взаимодействии галогеноводоров н родственных им соединений с несимметричными алкенами атом водорода присоединяется к более гидрогенизированному атому углерода, т. е. к атому углерода, содержащему большее число атомов водорода.
Это эмпирическое правило, а теперь, используя электронные представления, дадим пояснения к нему.
Направленность присоединения определяется поляризацией алкена в нереагирующем состоянии. Вследствие +I-эффскта и σ,π-сопряжения со стороны алкильных групп π-электронная плотность двойной связи смещена к более гидрогенизированному атому углерода, что определяет наиболее вероятное место присоединения протона.
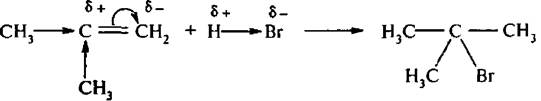
Кроме того, из двух возможных вариантов присоединения протона преимущественно реализуется тот, при котором в качестве промежуточного продукта присоединения образуется более устойчивый карбкатион:
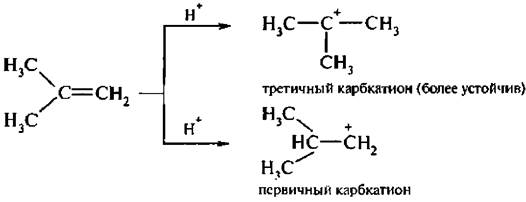
4. Присоединение воды (гидратация). Гидратация алкенов идет в присутствии минеральных кислот, чаше всего серной, и приводит к образованию спиртов:
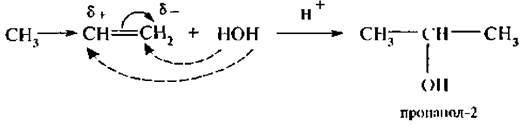
Механизм реакции следующий:
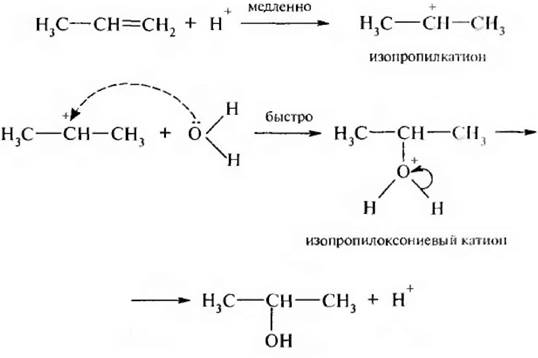
5. Присоединение гипогалогенных кислот (гипогалогенирование). Гипогалогенные кислоты (HOCl, НОВr, HOI) присоединяются к алкенам по двойной связи с образованием галогенгидринов. Механизм реакции электрофильный:
j
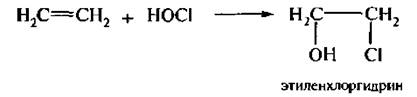
6. Озонирование алкенов. При взаимодействии алкенов с озоном образуются перекисные соединения, которые называются озонидами. При обработке цинком в уксусной кислоте они разрушаются с образованием альдегидов или кетонов в зависимости от строения алкена.
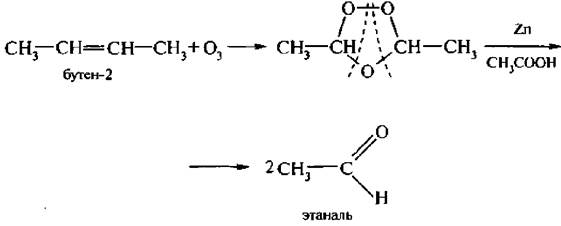
Сопоставляя продукты окисления, можно судить о наличии и положении двойной связи в этиленовом углеводороде.
7. Окисление раствором калия перманганата (реакция Вагнера, 1888г.) – гидроксилирование. Большое значение имеет реакция окисления алкенов КМnO4, которая известна как реакция Е. Вагнера. При взаимодействии алкенов с разбавленным водным раствором КМnO4 в слабощелочной или нейтральной среде образуются двухатомные спирты (гликоли):
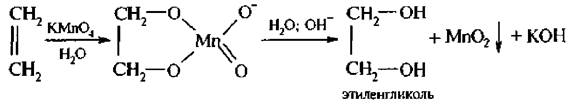
Эта реакция является качественной на кратные связи, по обесцвечиванию раствора перманганата калия можно судить о непредельности соединения.
8. Полимеризация алкенов. Полимеризация является важным свойством этиленовых углеводородов. Полимеризация – это образование высокомолекулярных соединений (полимеров) из низкомолекулярных (мономеров) в результате соединения молекул мономера.
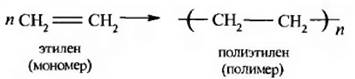
Группа –(–СН2-СН2–)--это элементарное звено полимера, то есть элементарный состав полимера не отличается от состава мономера.
9. АЛКАДИЕНЫ (ДИЕНОВЫЕ УГЛЕВОДОРОДЫ, ДИОЛЕФИНЫ)
Диеновые углеводороды – это углеводороды» содержащие в своей структуре две двойные связи. Общая формула – СnН2n.
Простейшим представителем алкадиенов является аллен, или пропадиен Н2С=С=СН2.
Названия алкадиенов по заместительной номенклатуре ИЮПАК образуют путем прибавления к корню предельного углеводорода суффикса -диен с указанием положения каждой из двойной связи. Например:
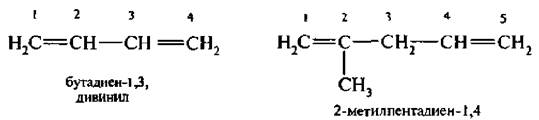
Для некоторых алкадиенов сохранились тривиальные названия.
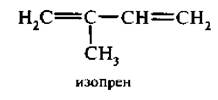
В зависимости от взаимного расположения двойных связей алкадиены делятся на три группы.
1. Алкадиены с кумулированными двойными связями – алленовые углеводороды, В алленовых углеводородах двойные связи находятся в положении 1,2.
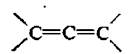
Представителем является аллен.
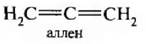
2. Алкаднены с изолированными двойными связями. Двойные связи отделены друг от друга двумя и большим числом простых связей.
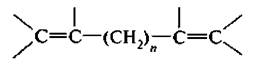
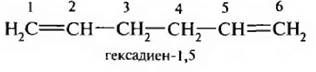
3. Алкалиены с сопряженными, конъюгяроваиными двойными связями. Двойные связи разделяются одной простой связью. Первым представителем этого ряда является дивинил, или бутадиен-1,3.
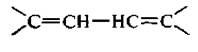
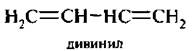
Дата добавления: 2015-09-29; просмотров: 5240;
