Гомологический ряд алканов. Номенклатура и изомерия. Радикалы алканов. Способы получения.
Алканы — ациклические насыщенные углеводороды общей формулы
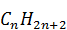
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109°28'. Cвязи C—C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью. Длина связи C—C составляет 0,154 нм, длина связи C—H — 0,1087 нм.
Простейшим представителем класса является метан (CH4). Углеводород с самой длинной цепью — нонаконтатриктан C390H782 синтезировали в 1985 году английские химики И. Билл и М. К. Уайтинг.
Атомы углерода различаются по месту положения в цепи. Различают первичный, вторичный, третичный, четвертичный, в зависимости от связи с атомами углерода.
Для изображения трехмерных молекул на плоскости привлекают стереохимические и проекционные формулы.
Электронная плотность сигма-связи между двумя sр3 гибридизованными атомами распределена равномерно относительно оси связи и следовательно сигма – связь обладает осевой симметрией. Вокруг простой связи С-С возможно свободное вращение. УВ с более разветвленной цепью принимают более сложные геометрические формы. для простого углеводорода этана характерна полная свобода вращения вокруг одинарной С—С-связи. Поэтому молекула этана может принимать множество различных конформаций в зависимости от угла поворота одного атома углерода относительно другого; однако все эти конформации легко переходят одна в другую в результате вращения замещающих групп вокруг С—С-связи. Заторможенная конформация этана более устойчива по сравнению со всеми остальными и поэтому встречается чаще других, тогда как заслоненная конформация наименее устойчива. Ни одну из этих двух конформационных форм этана невозможно выделить в чистом виде, так как между ними существует равновесие и они свободно переходят одна в другую. Поворот одной группы относительно другой происходит без нарушения химического строения молекулы, не меняет межатомные расстояния, валентные углы и т.д. Меняется лишь взаимное расположение в пространстве атомов.
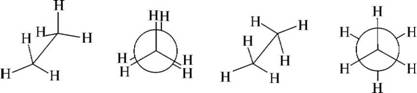
Геометрические формы молекулы, переходящие друг в друга путем вращения вокруг сигма –связей, называют конформациями.
Заслоненная и заторможенная конформация.
Проекции Ньюмана.
Зигзагообразные конформации.
Способы получения
1. Выделение УВ из природного сырья.
Природными источниками алканов являются нефть, попутные нефтяные газы и природный газ. В ней также содержатся в небольшом количестве водород , азот- и серосодержащие соединения. Природный газ состоит в основном из метана (до 95%) с примесью этана и пропана.
2. Восстановление галогенпроизводных алканов:
При каталитическом гидрировании в присутствии палладия галогеналканы превращаются в алканы:
R—CH2Cl + H2 → R—CH3 + HCl
Восстановление иодалканов происходит при нагревании последних с иодоводородной кислотой:
R—CH2I + HI → R—CH3 + I2
3. Сочетание галогеналканов. Реакция Вюрца.

Если участвуют различные галогеналканы получается смесь различных алканов..
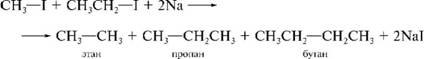
4. Гидрирование непредельных углеводородов
Из алкенов
CnH2n + H2 → CnH2n+2
Из алкинов
CnH2n-2 + 2H2 → CnH2n+2
5. Щелочное плавление солей карбокислот.
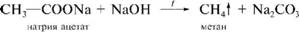
Дата добавления: 2015-09-11; просмотров: 1958;
