Способы получения аренов
1. Циклотримеризация алкинов
Ацетилен пропускают над активированным углем при повышенной температуре. Реакция была открыта Зелинским.

2. Обработка ацетона концентрированной H2SO4

3. Дегидрогенизация алициклических соединений
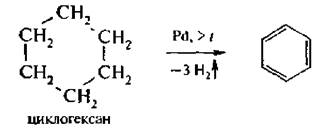
Эта реакция показывает взаимосвязь между ароматическими и али-циклическими соединениями.
4. Реакция Вюрца – Фиттига
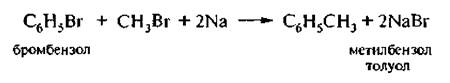
Эта реакция чаше всего используется для получения гомологов бензола,
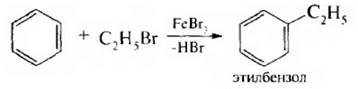
5. Алкилирование ароматических углеводородов по Фриделю – Крафтсу,
Физические свойства
Бензол и его низшие гомологи представляют собой жидкости, обладающие специфическим запахом. Ароматические углеводороды не растворимы в воде и хорошо растворяются в органических растворителях. Многие из них сами являются хорошими растворителями для других органических веществ. Из-за высокого содержания углерода горят коптящим пламенем.
Химические свойства
Реакционная способность бензола и его гомологов определяется главным образом наличием в структуре замкнутой π-электронной системы, которая является областью повышенной электронной плотности. Ароматические углеводороды, как и алкены, обладают нуклеофильным характером. Однако» в отличие от ненасыщенных соединений, при взаимодействии с электрофильными реагентами арены более склонны к реакциям замещения, а не присоединения, поскольку при этом сохраняется их ароматический характер. Эти реакции носят название реакций электрофильного замещения SL.
Реакции присоединениялля аренов менее характерны, так как они приводят к нарушению ароматичности, с трудом вступают ароматические углеводороды и в реакции оксиления.
I. Реакции электрофильного замещения (SE)
При атаке электрофильной частицей π-электронной системы бензольного кольца в результате электростатического взаимодействия образуется неустойчивый π-комплекс;
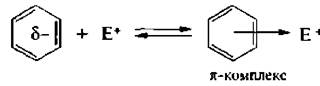
Далее электрофил «вырывает» пару электронов из ароматического секстета бензольного ядра и между ним и одним из атомов углерода образуется σ-связь. Таким образом нарушается ароматичность бензольного ядра, образуется карбкатион – σ-комплекс.
Делокализаиию положительного заряда в с-комплексе можно представить с помощью резонансных структур (I-III):

Образование σ-комплекса является наиболее высокоэнергетичной стадией реакции, определяющей ее скорость, σ-Комплекс не устойчив, он отщепляет протон от атома углерода, связанного с электрофилом, благодаря чему восстанавливается ароматичность бензольного кольца.
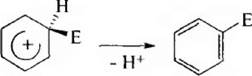
К наиболее важным реакциям SE относятся реакции нитрования, сульфирования, галогенирования, алкилирования и ацилирования.
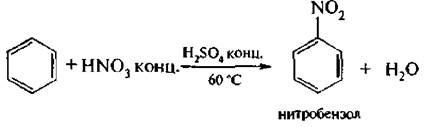
1. Нитрование. В качестве нитрующих агентов чаще используют кон центрированную азотную кислоту или смесь концентрированной азотной и серной кислот (нитрующая смесь):
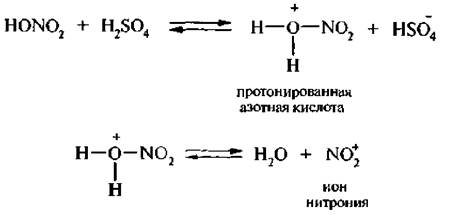
Атакующей электрофильной частицей в реакции является ион нитрония NO2+, который образуется в результате кислотно-основного взаимодействия между азотной и серной кислотами, где азотная кислота играет роль основания:
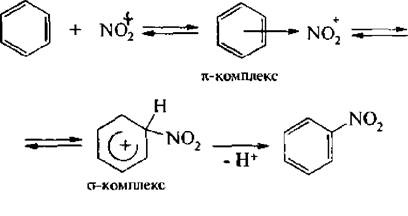
Ион нитрония атакует π-электронную систему бензольного ядра. В результате реакции образуется нитробезол.
2. Сульфирование – это процесс замещения атома водорода в бензольном ядре на сульфогруппу – SO3H. Для сульфирования бензола и его гомологов применяют концентрированную серную кислоту или олеум (раствор триоксида серы SO3 в cерной кислоте):

Особенности механизма сульфирования аренов изучены недостаточно. Однако экспериментальные данные свидетельствую о том, что атакующей электрофильной частицей служит триоксид серы SO3:
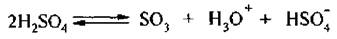
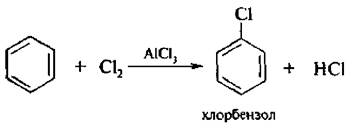
3. Галогенирование. Бензол и его гомологи хлорируются, бромируются и йодируются. Замешение атома водорода в бензольном ядре на атом хлора или брома осуществляют в присутствии катализаторов – кислот Льюиса (AlCl3, FeBr3, ZnCl2 и др.):
Под действием катализатора молекула галогена поляризуется. Атакующей электрофильной частицей служит либо комплекс поляризованной молекулы галогена с кислотой Льюиса, либо катион галогена, образующийся в процессе ионизации данного комплекса:
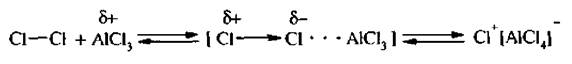
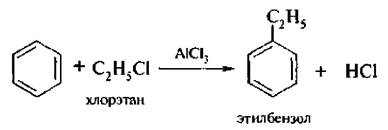
4. Алкилирование по Фриделю – Крафтсу. Для введения алкильной группы в молекулу ароматического соединения в качестве электрофильных реагентов чаше всего используют галогеналканы. Взаимодействие происходит в присутствии катализаторов – кислот Льюиса:
Атакующей электрофильной частицей является карбкатион, который образуется при взаимодействии алкилирующего агента и катализатора:
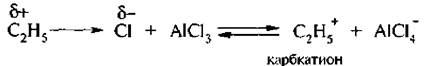
Для алкилирования аренов также могут быть использованы спирты (реакции протекают в присутствии кислот Льюиса или минеральных кислот – Н3РO4, Н2SО4) или алкены (в этом случае алкилирование требует присутствия кислот Льюиса и минеральной кислоты как источника протонов).
По своему механизму реакция алкилирования аналогична реакциям нитрования, сульфирования и галогенирования.
5. Ацилирование по Фриделю – Крафтсу. Ацилированием называют процесс введения в молекулу органического соединения ацильной группы
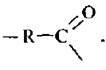
Ацилирование бензола и его гомологов обычно осуществляют галогенангидридами карбоновых кислот в присутствии кислот Льюиса:
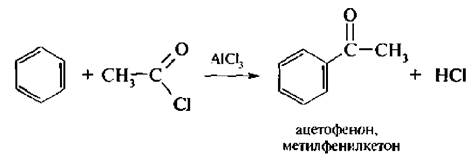
Электрофилом, атакующим бензольное кольцо, является либо ацилиевый ион СН3–+С=О, либо комплекс ацилгалогенида с катализатором CH3+COAlCl4-:
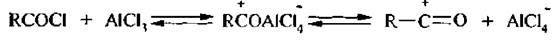
Для введения ацильной группы могут быть использованы и ангидриды карбоновых кислот.
Дата добавления: 2015-09-29; просмотров: 3653;
