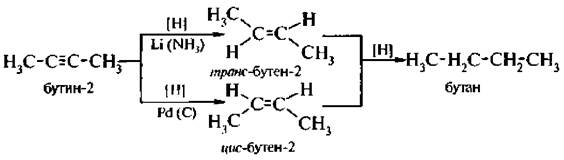
Реакции присоединения. 1. Гидрирование. Присоединение водорода проходит ступенчато по месту тройной связи в присутствии катализаторов
1. Гидрирование. Присоединение водорода проходит ступенчато по месту тройной связи в присутствии катализаторов. Такой процесс называется стереоселективным гидрированием. Конечным продуктом будет алкан.
2. Галогенироеание. Алкины довольно легко присоединяют по месту тройной связи одну молекулу хлора или брома, в результате образуется преимущественно транс-дигалогеналкен. Присоединение второй молекулы галогена идет труднее. Механизм реакции аналогичен галогенированию алкенов (АЕ).
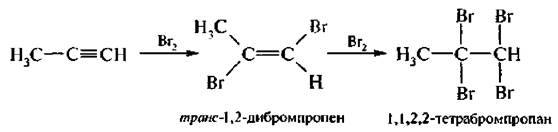
Обесцвечивание бромной воды – качественная реакция на тройную связь,
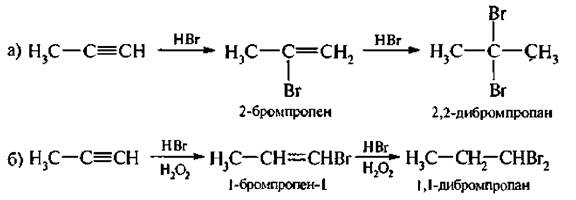
3. Гидрогалогенирование. Присоединение галогеноводородов(НCl, НВr) происходит также в две стадии с образованием соответственно моногалогензамещенных или геминальных дигалоген алканов.
Реакция может проходить по механизму электрофильного или радикального присоединения. В первом случае соблюдается правило Марковникова. При радикальном механизме наблюдается противоположное направление присоединения.
4. Гидратация (реакция Кучерова). Ацетилены очень легко присоединяют воду в кислой среде в присутствии солей ртути (II) в качестве катализатора. Присоединение происходит в соответствии с правилом Марковникова. При этом из ацетилена образуется уксусный альдегид, а из других алкинов – кетоны:
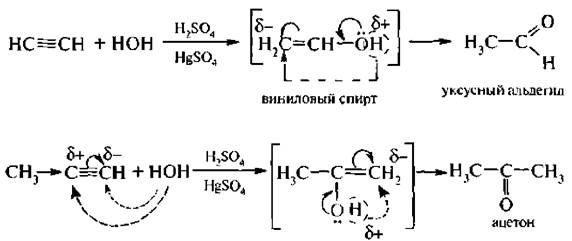
Гидратация алкинов протекает через стадию образования непредельных спиртов, содержащих гпдроксильную группу у атома углерода с двойной связью. Такие спирты неустойчивы. В процессе образования они изомеризуются в карбонильные соединения. Эту закономерность установил в 1877 г. русский химик А.П. Эльтеков, и она получила название правила Эльтекова.
Реакция Кучерова лежит в основе производства уксусного альдегида, уксусной кислоты и уксусного ангидрида,
5. Присоединение спиртов и кислот. Этим способом получают эфиры не существующего в свободном состоянии винилового спирта. Реакция протекает по механизму нуклеофильного присоединения (А.):
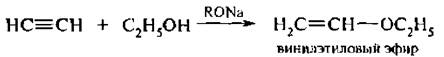
Катализаторами нижеприведенной реакции являются соли ртути (II), меди (I), кислоты Льюиса.
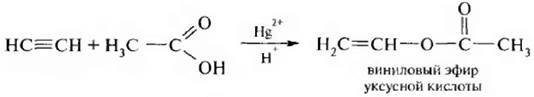
Виниловый эфир уксусной кислоты используется для производства полимера поливинилацетата (ПВА).
Реакции замещения
1. Образование ацетиленидов. Способность ацетиленов с концевой тройной связью отдавать протон позволяет говорить о них как о соединениях, проявляющих кислотные свойства. И хотя их кислотность очень мала, тем не менее алкины способны к реакциям замещения и реагируют с сильными основаниями, образуя при этом соли. Такие соли называютацетиленидами.
Если пропускать через аммиачный раствор солей одновалентной меди или серебра ацетилен. из раствора вы падает соответствен но красно-коричневый осадок ацетиленида меди или белый осадок ацетиленида серебра:
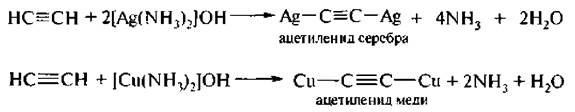
Ацетилен иды тяжелых металлов в сухом виде чувствительны к трению, удару и легко взрываются.
Ацетилен иды натрия представляют особый интерес как промежуточные соединения для синтеза других алкинов. Они легко вступают в реакцию нуклеофильного замещения с галогеналканами:
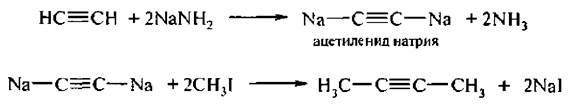
Аналогично протекает реакция с реактивами Гриньяра (магний-органическими соединениями). Русскими учеными Чугаевым и Цeревитиновым было предложено определение подвижности атомов водорода с помощью магнийорганических соединений в органических соединениях:

По количеству атомов водорода выделяется эквивалентное количество СН4. Метан собирают, определяют объем и рассчитывают число подвижных атомов водорода. Этот метод имеет аналитическое значение.
2. Замещение водорода при Csp на галоген. Атомы водорода при углероде стройной связью замещаются на атомы галогенов (хлор, бром, йод) при действии галогенов в присутствии щелочей.
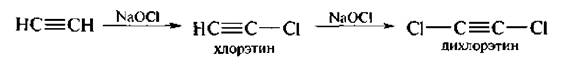
Реакции окисления
Алкины, подобно алкенам, подвергаются окислению по месту тройной связи. Продуктами реакции являются соответствующие карбоновые кислоты, В качестве окислителей используют перманганат калия в нейтральной или щелочной среде, озон и др.
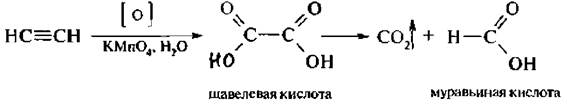
При окислении ацетилена в нейтральной среде образуется щавелевая кислота, которая в этих условиях декарбоксилируется и конечны м продуктом будет муравьиная кислота. Гомологи ацетилена окисляют в щелочной среде с разрывом по месту тройной связи.
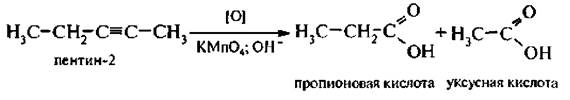
Реакция окисления алкинов используется для определения их строения.
Полимеризация алкинов (димеризация, циклотримеризащш)
Алкины способны полимеризоваться в нескольких направлениях. В присутствии хлорида меди (I) и хлорида аммония ацетилен димеризуется с образованием винилацетилена:
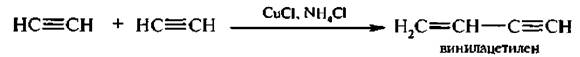
Винилаиетилен является исходным продуктом в производстве хлоропреновых каучуков.
При нагревании в присутствии активированного угля или комплексных никельорганических катализаторов ацетилен циклотримеризуется с образованием бензола:
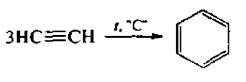
Это один из синтетических способов получения ароматических углеводородов.
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ)
Ароматическими первоначатьно называли органические соединения, которые или сами имели приятный запах, или же выделялись из природных вешеств, обладающих приятным запахом. В последствии среди них были обнаружены соединения с приятным и неприятным запахом, а также соединения без запаха. Однако название за большой группой органических соединений, проявляющих сходные с бензолом свойства, сохранилось.
Кароматическим углеводородам или аренам относятся соединения, молекулы которых содержат одно или несколько бензольных колец.
В зависимости от числа бензольных циклов, входящих в состав молекулы, различают одноядерные (моноциклические) и многоядерные (полициклические) арены.
11. МОНОЯДЕРНЫЕ АРЕНЫ
Простейшим представителем одноядерных ароматических соединений является бензол (С6Н6).
Впервые бензол был получен английским ученым М. Фарадеем в 1825 г. из светильного газа, образующегося в процессе переработки каменного угля. Однако строение его молекулы в течение многих лет оставалось загадкой для химиков. Несмотря на то, что формула С6Н6 предполагает достаточно выраженный ненасыщенный характер, бензол, в отличие от непредельных соединений, оказался относительно инертным веществом. Он сравнительно устойчив к нагреванию и действию окислителей, практически не вступает в характерные для ненасыщенных соединений реакции присоединения. Наоборот, для бензола более характерными оказались не свойственные непредельным соединениям реакции замещения.
Составу С6Н6 приписывались разные структурные формулы, но все они не объясняли в полной мере химических свойств бензола,
В 1865 г немецкий химик Кекуле предложил формулу бензола, представляющую собой цикл из шести атомов углерода с чередующимися простыми и двойными связями;
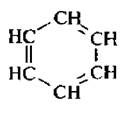
Формула Кекуле предполагает равноценность всех атомов углерода и водорода в молекуле.
В соответствии с формулой Кекуле бензол должен иметь два 1,2-дизамещенных изомера:
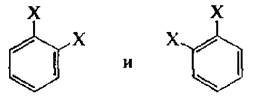
Экспериментально же было установлено, что 1,2-дизамещенные производные бензола не имеют изомеров положения, т. е. они существуют в виде одного соединения.
Для объяснения этого противоречия в 1872 г. Кекуле выдвинул осцилляционную гипотезу, согласно которой двойные связи в молекуле не фиксированы, а непрерывно перемешаются (осциллируют) между двумя возможными положениями:

Правильно отображая некоторые свойства бензола, формула Кекуле тем не менее не согласовывалась с рядом установленных фактов. Все это возвращало химиков к пересмотру структуры бензола.
В соответствии с современными представлениями, основанными на данных квантовой химии и физико-химических исследований, молекула бензола представляет собой правильный плоский шестиугольник. Все углеродные атомы находятся в состоянии sp2-гибридизации. За счет sp2-гибрилизованных атомных орбиталей каждый атом углерода образует три σ-связи (одну с атомом водорода и две с соседними атомами углерода). Негибридизованная р-атомная орбиталь участвует в образовании ароматического секстета. Облака р-электронов имеют форму объемной восьмерки и расположены перпендикулярно плоскости цикла, которая разделяет их пополам.
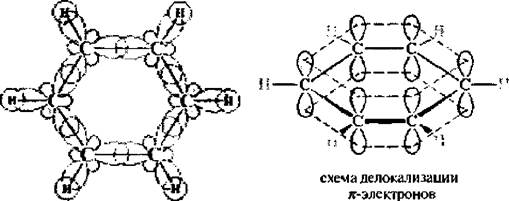
Если посмотреть на проекцию π-электронной плотности сверху, то мы можем увидеть такую картину:
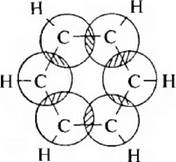
Образование замкнутой сопряженной системы (ароматического секстета) является для молекулы бензола энергетически выгодным. Экспериметально установлено, что сопряжение в цикле приводит к уменьшению энергии на 150,7 кДж/моль, по сравнению с расчнтанной для циклогексатриена. Эта разность составляет энергию сопряжения,
В бензольном кольце нет простых и двойных связей в прямом понимании этого слова. Такую связь называют ароматической. Если длина простой связи С–С в алканах составляет 0,154 нм, длина двойной связи в алкенах – 0,134 нм, то длина С–С связи в молекуле бензола равна 0,140 нм, т. е. является промежуточной между длиной одинарной и двойной связи.
Совокупность специфических свойств бензола – высокая стабильность, инертность в реакциях присоединения, склонность к реакциям замещения, получила общее название «ароматичность», или «ароматические свойства».
Что же требуется для того, чтобы мы имели право отнести соединение к ароматическому ряду?
а) для проявления ароматического характера молекула должна прежде всего иметь плоское строение;
б) молекула должна иметь замкнутую сопряженную систему;
в) количество π-электронов должно соответствовать формуле 4n + 2. где п = 0,1, 2,3 и т. д. (данная закономерность была сформулирована в 1931 г немецким ученым Э. Хюккелем).
Номенклатура и изомерия
По заместительной номенклатуре ИЮПАК одноядерные арены рассматривают как производные бензола.
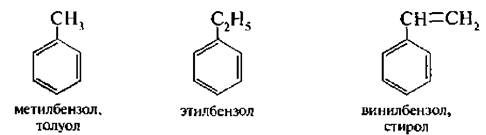
При наличии в кольце двух и более заместителей их положение указывают цифрами. Нумерацию атомов углерода бензольного кольца осуществляют таким образом, чтобы заместители имели возможно меньшие номера.
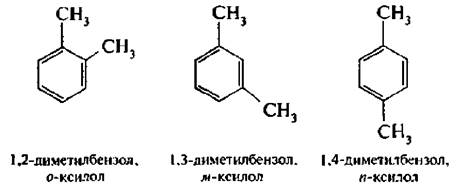
В дизамещенных производных бензола наряду с цифровым обозначением положений заместителей применяют приставки: орто-(о-) положение – 1,2; мета-(м-) положение – 1,3 и пара-(п-) положение – 1,4.
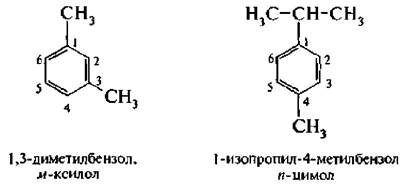
Кроме названий по заместительной номенклатуре сохранились и тривиальные названия: толуол, ксилол, кумол и др.
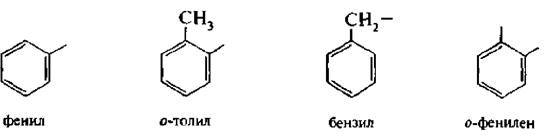
Одновалентные радикалы аренов имеют общее название – арилы (Аr). Двухвалентные радикалы бензола называют фениленами (о-, м-, п-)
Изомерия гомологов бензола обусловлена разными структурами, числом и положением заместителей в бензольном кольце.
Для однозамещенных гомологов бензола характерна изомерия, связанная с разной структурой заместителя.
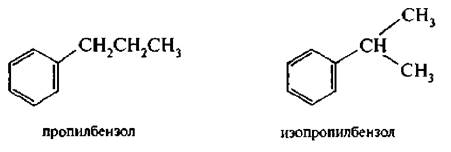
Дизамещенные производные бензола существуют в трех изомерных формах, в зависимости от взаимного расположения в бензольном кольце (изомеры положения).
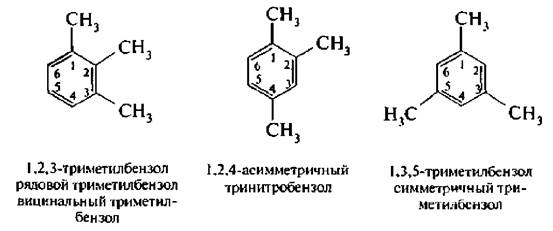
Для тризамещенных бензолов с одинаковыми заместителями в бензольном кольце существуют также три изомера:
Дата добавления: 2015-09-29; просмотров: 3369;
