I. РЕАКЦИИ НА КАТИОНЫ
1. Ион аммония (NH4+)
1.ГФРастворы едких щелочей (NaOH, KOH) выделяют из растворов солей аммония при нагревании газообразный аммиак (реакция разложения).
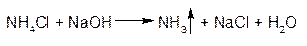
Выделяющийся аммиак обнаруживают следующими способами:
1) по характерному запаху аммиака;
2) по посинению красной лакмусовой бумажки или по покраснению бесцветной фенолфталеиновой;
3) если к отверстию пробирки поднести фильтровальную бумагу, смоченную раствором нитратом ртути (I), на ней появляется чёрное пятно вследствие выделения металлической ртути:
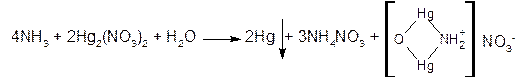
2. Реактив Несслера – раствор тетрайодмеркурата (II) калия в КОН – K2[HgI4] образует с солями аммония желтое окрашивание (следы аммония) или желто-бурый осадок:
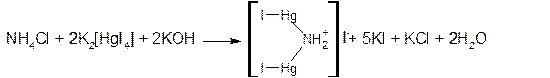
2. Ион натрия (Na+)
1. ГФСоль натрия, смоченная хлористоводородной кислотой и внесенная в бесцветное пламя, окрашивает его в желтый цвет.
2. ГФСоли натрия образуют желтый кристаллический осадок с цинка уранилацетатом в уксуснокислой среде.
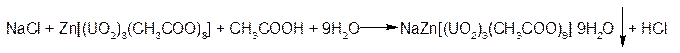
Осадок нерастворим в уксусной кислоте.
3. ГФ ХII (вместо реакции 2.) К 2 мл раствора натриевой соли (7–10 мг натрий-иона) прибавляют 2 мл 15 % раствора калия карбоната и нагревают до кипения; осадок не образуется. К раствору прибавляют 4 мл раствора калия пироантимоната и
нагревают до кипения. Охлаждают в ледяной воде и при необходимости потирают внутренние стенки пробирки
3. Ион калия (К+)
1. ГФСоль калия, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет, а при рассмотрении через синее стекло пламя имеет пурпурно-красный цвет.
2. ГФСоли калия с раствором винной кислоты в присутствии натрия ацетата и спирта образуют белый осадок кислой соли калия гидротартрата. Осаждению способствует: охлаждение растворов, встряхивание пробирки и потирание стеклянной палочкой о стенки пробирки.
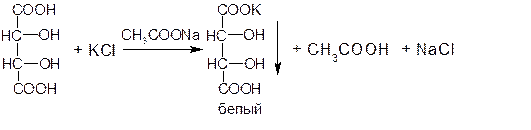
Реакция проводится в среде натрия ацетата, необходимого для связывания выделяющихся ионов водорода. При этом образуется уксусная кислота, в которой осадок КНС4Н4О6 нерастворим:
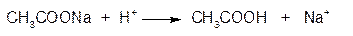
Осадок калия гидротартрата растворяется в минеральных кислотах и растворах едких щелочей:
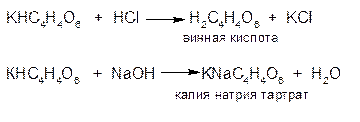
3.ГФСоли калия с натрия кобальтинитритом (гексанитро (III) кобальтатом натрия) в уксуснокислой среде; образуют желтый кристаллический осадок гексанитро(III) кобальтата калия и натрия.
KCI + Na3[Co(NO2)6]→ K2Na[Co(NO2)6]↓ + 2KNO3
4. Ион кальция (Са2+)
1. ГФСоль кальция, смоченная хлористоводородной кислотой, окрашивает бесцветное пламя горелки в кирпично-красный цвет.
2. ГФРаствор аммония оксалата осаждает из растворов солей кальция белый осадок кальция оксалата:
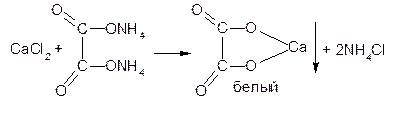
Осадок растворим в разведенных минеральных кислотах и нерастворим в уксусной кислоте:
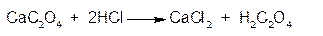
5. Ион магния (Mg2+)
ГФСоли магния с раствором натрия гидрофосфата в присутствии аммония гидроксида и аммония хлорида образует белый кристаллический осадок магний-аммоний фосфата:
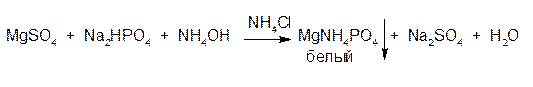
Осадок растворяется в минеральных кислотах и уксусной кислоте:
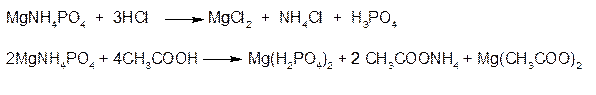
Реакцию осаждения магний-аммоний фосфата проводят в присутствии аммония хлорида во избежание выпадения в щелочной среде осадка Mg(OH)2. Следует избегать и избытка NH4CI, так как в этом случае образуются растворимые комплексы [MgCI3]- и [MgCI4]2-.
6. Ион железа (II) (Fe2+)
1.ГФ Натрия сульфид образует с солями Fe2+ черный осадок:
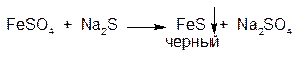
Осадок растворим в минеральных кислотах:
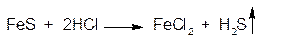
2.ГФРастворы солей железа (II) с раствором калия феррицианида (гексацианоферратом (III) калия) образуют синий осадок феррицианида железа(II) (гексацианоферрата(III) железа(II)) «турнбулевая синь», возможно также образование KFe[Fe(CN6)]:
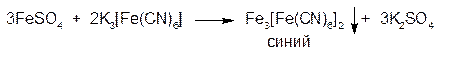
Осадок нерастворим в минеральных кислотах, но разрушается едкими щелочами с образованием гидроксида железа (II) – зеленый осадок, буреющий на свету:
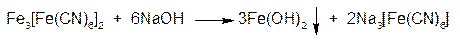
7. Ион железа (III) (Fe3+)
1.ГФ Натрия сульфид осаждает из растворов солей железа (III) осадок сульфида железа черного цвета:
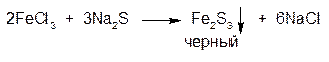
Осадок растворим в минеральных кислотах:
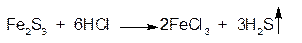
2.ГФ Растворы солей железа (III) образуют в кислой среде хлористоводородной кислоты разведенной с раствором калия ферроцианида (гексацианоферрата (II) калия) синий осадок «берлинской лазури»:
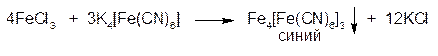
Осадок нерастворим в минеральных кислотах, но разрушается едкими щелочами с образованием бурого осадка Fe(OH)3:
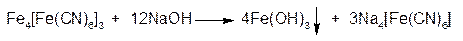
3. ГФ При добавлении к раствору соли Fe3+ раствора аммония тиоцианата образуется тиоцианат железа красного цвета:
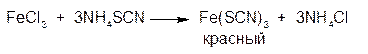
8. Ион серебра (I) (Аg+)
1.Реакция восстановления Ag+ из аммиачного раствора серебра нитрата до металлического серебра при нагревании с раствором формальдегида (реакция «серебряного зеркала»):
AgNO3 + 2NH4OH →[Ag(NH3)2]NO3 + 2Н2O
t0
2[Ag(NH3)2]NO3 + HCOH + H2O → 2Ag↓ + HCOONH4 + 2NH4NO3 + NH3↑
Металлическое серебро образует на стенках пробирки тонкую блестящую пленку - «серебряное зеркало».
2. Реакция осаждения кислотой хлороводородной или натрия хлоридом. Образуется белый творожистый осадок AgCl:
AgNO3 + HCl → AgCl↓+HNO3
Белый творожистый
Осадок серебра хлорида нерастворим в кислоте азотной разведенной, растворяется в растворе аммиака с образованием комплексного соединения:
AgCl + 2NH4OH→[Ag(NH3)]Cl + 2Н2O
3. Реакция осаждения раствором натрия гидроксида или раствором аммиака:
2AgN03 + 2NH4OH → Ag2O↓ + 2NH4NO3
черный осадок
Осадок серебра оксида нерастворим в избытке натрия гидроксида, растворяется в избытке раствора аммиака с образованием комплексного соединения:
Ag2O + 4NH4OH → 2[Ag(NH3)2]OH +ЗН2O
9. Ион цинка (Zn2+)
1. ГФРастворы солей цинка образуют с сульфид-ионом осадок цинка сульфида белого цвета:
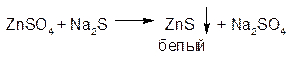
Осадок легко растворим в разведенной соляной кислоте и нерастворим в уксусной:

2. ГФСоли цинка с гексацианоферратом (ΙΙ) калия образуют белый студенистый осадок гексацианоферрата (ΙΙ) цинка:
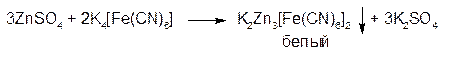
Осадок нерастворим в разведенных минеральных кислотах, растворим в щелочах.
3.Раствор гидроксида натрия выделяет из растворов солей цинка белый студенистый осадок Zn(OH)2, растворимый в избытке реактива с образованием цинкатов:
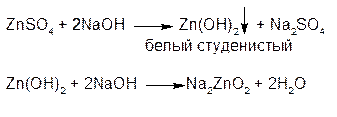
доказывает амфотерность Zn2+ цинка и растворимость оксида в кислотах и щелочах
ZnO + 2HCl → ZnCl2 + H2O
ZnO + 2NaOH → Na2ZnO2 + H2O
10. Ион свинца (Pb2+)
1. Калия йодид образует с солями свинца (ΙΙ) желтый осадок дийодида свинца, растворимый в избытке реактива с образованием бесцветного раствора:
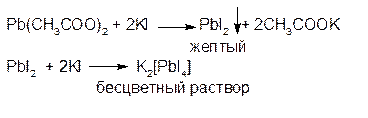
2. Растворы хромата калия и дихромата калия образуют с растворами солей свинца желтый осадок хромата свинца:
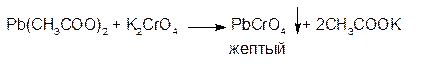
11. Ион висмута (Bi3+)
1.ГФ Йодид калия из подкисленных растворов солей висмута выделяет черный осадок, который растворяется в избытке реактива с образованием раствора оранжево-желтого цвета (осаждение с последующим комплексообразованием):
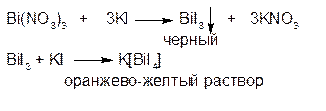
2.ГФ Соли висмута с натрия сульфидом образуют коричневато-черный осадок висмута сульфида, растворимый в концентрированной азотной кислоте.
2BiCl3+3Na2S → Bi2S3↓+3NaCl
12. Ион меди (Cu2+)
1. Раствор аммиака осаждает сначала из растворов солей меди (ΙΙ) осадок основной соли голубовато-зеленого цвета, который растворяется в избытке реактива с образованием окрашенного в интенсивно-синий цвет прозрачного комплекса:
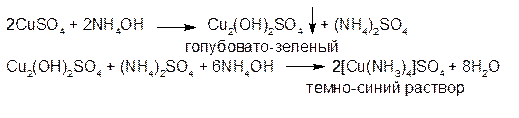
2. Гексацианоферрат (II) калия образует с солями меди (II) красно-бурый осадок гексацианоферрата (II) меди:
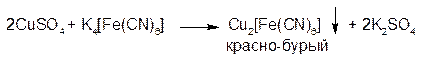
13. Ион ртути (II) (Нg2+)
1.ГФ Растворы солей ртути (II) с эквимолекулярным количеством йодида калия образуют красный осадок дийодида ртути, растворимый в избытке реактива.
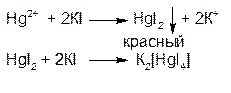
2. ГФ При действии щелочей на водные растворы солей ртути (II) образуется желтый осадок ртути оксида (II):
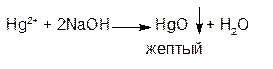
14. Алюминий (Аl3+)
1. ГФ ХIIОколо 15 мг лекарственного средства растворяют в 2 мл
воды. К полученному раствору или к 2 мл раствора, приготовленного как
указано в частной фармакопейной статье, прибавляют 0,5 мл хлористоводо-
родной кислоты разведенной 8,3 % и 0,5 мл реактива тиоацетамида; осадок
не образуется. Затем по каплям прибавляют раствор натрия гидроксида раз-
веденный 8,5 %; образуется гелеобразный белый осадок, растворимый при
последующем прибавлении раствора натрия гидроксида разведенного 8,5 %.
Постепенно прибавляют 10 % раствор аммония хлорида; снова образуется
гелеобразный белый осадок.
2.Реакция осаждения раствором натрия гидроксида или раствором аммиака:
Al3+ + 3NaOH →Al(OH)3↓ + 3Na+
Эквив. Белый желатинообразный осадок
Al3+ + 3NH4OH→Al(OH)3↓ + 3NH4+
Al(OH)3 + NaOH → NaAl(OH)4↓
| Реакция прокаливания с раствором кобальта нитрата: 4А13+ + 2Со(NОз)2 → 2Со(АlO2)2 + 4NO↑ |
Плав синего цвета
Дата добавления: 2015-09-07; просмотров: 9704;
