Каталитический механизм
Механизмы катализа довольно различны.
1) Например, в цепных реакциях катализатор может облегчать реакцию начала цепи.
Например:
Na пары
 H2 + Cl2 2HCl
H2 + Cl2 2HCl
здесь Na взаимодействует Cl2 :
Na + Cl2 = NaCl + Cl·
Ингибитор в цепной реакции может действовать как реагент, приводящий к обрыву цепи. Такое действие производит тетраэтилсвинец или карбонил железа, которые добавляют в бензин, чтобы избежать преждевременной детонации в цилиндрах двигателя.
2) В других реакциях катализатор может образовывать промежуточные продукты с реагентами, облегчая образование конечных продуктов путем снижения энергии активации.
Напрмер, в реакции
A + B = AB (a)
Катализатор C может реагировать с A с образованием продукта AC
A + C = AC (b)
Соединение AC реагирует с B, образуя AB и освобождая катализатор C:
AC + B = AB + C (c)
Если энергии активации реакций (b) и (c) значительно меньше, чем энергия активации (a), C - положительный катализатор реакции (a)
Катализатор всегда изменяет энергию активации (снижая в случае положительного катализа)
Во всех гетерогенных каталитических реакциях, процесс происходит на поверхности катализатора. Это означает, что природа поверхности и ее размер, химические соединения поверхностного слоя, их состояние и структура имеют непосредственную связь с каталитической активностью катализатора.
Каталитическая активность - это величина характеризующая изменение скорости реакции в результате участия катализатора в химической реакции. Каталитическая активность обычно ассоциируется с адсорбцией реагентов на наиболее активных участках катализатора.
Разность концентраций компонента в поверхностном слое и в объеме раствора (или объеме смеси газов) называется адсорбцией.
Существуют понятия - положительная адсорбция (когда концентрация растворенного вещества в поверхностном слое больше, чем концентрация его в объеме раствора) и отрицательная адсорбция (когда концентрация растворенного вещества в поверхностном слое меньше, чем в объеме раствора).
Физическая адсорбция происходит благодаря 3-м составляющим межмолекулярного притяжения – дисперсионному, ориентационному и индукционному взаимодействиям.
Дисперсионное взаимодействие -возникает под действием дисперсионных сил (или лондоновские силы, названы по имени немецко-американского физика Фрица Лондона) - тип взаимодействий между атомами и молекулами под действием мгновенно индуцированных диполей. Эти силы действуют между молекулами, не обладающими постоянными дипольными моментами.
Ориентационное взаимодействие - возникает между молекулами, имеющими постоянный дипольный момент, при этом молекулы ориентируются определенным образом.
Индукционное взаимодействие -подобно дисперсионному, возникает между молекулами, имеющими постоянный дипольный момент и молекулами с мгновенно индуцированным диполем.
Химическая адсорбция (хемисорбция) - происходит благодаря химическому взаимодействию адсорбента и адсорбата.
Адсорбент - (чаще всего) твердое вещество на поверхности которого "собираются" молекулы другого вещества из объема раствора или газа.
Адсорбат - вещество, молекулы которого переходят из объема раствора (или газа) на поверхность твердого вещества.
Количество газа или растворенного вещества, адсорбированного данным количеством адсорбента зависит от природы газа или раствора и от условий, при которых происходит процесс. - прежде всего от давления газа (или от концентрации растворенного вещества в растворе) и от температуры. Влияние давления (или концентрации) на количество адсорбированного вещества описываются кривыми, которые называются -изотермами адсорбции.
Существуют различные аналитические выражения изотерм адсорбции.
- изотерма Фрейндлиха, уравнение:
a= k×p1/n
гдe a – количество адсорбированного газа (aдсорбата)
p – равновесное давление газа,
k и n – эмпирические параметры, постоянные для данного адсорбента и газа при постоянной температуре. Уравнение дает хорошее согласие с экспериментальными данными при средних давлениях.
- изотерма Ленгмюра:
a = k× 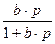
гдe k и b - постоянные для данной изотермы. Уравнение дает хорошее описание при низких и высоких давлениях.
Диффузия
Диффузия в растворах, газах и твердых веществах - естественных процесс который происходит благодаря тепловому движению частиц вещества, и который приводит к распространению частиц вещества по всему объему (массе), или выравниванию концентрации одного и того же вещества в пределах всего объема (массы).
Процесс описывается законами: 1-й закон Фика (1855)
Скорость диффузии определяется уравнением:
dm = D×A× 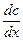 dt
dt
гдe dm -количество вещества, пересекающее сечение A в интервал времени dt, когда концентрация изменяется на dc на расстоянии dx.
Зависимость концентрации в данный момент времени определяется 2-м законом Фика:
| dc | = D× | d2c | |
| dt | dx2 |
Константа D - называется диффузионным коэффициентом. Он численно равен количеству вещества, которое диффундирует в единицу времени (1сек) через сечение площадью 1 cm2, и когда концентрация уменьшается на единицу за 1 см пути.
Дата добавления: 2015-11-04; просмотров: 897;
