Кислые красители
Исторически для окраски белков в геле были прежде всего
использованы давно апробированные промышленные красители
для шерсти — сложные молекулы с несколькими ароматически-
ми кольцами и заряженными группами. Механизм их взаимодей-
ствия с белками еще далеко не ясен. По-видимому, первоначаль-
ное связывание идет за счет кулоновского взаимодействия суль-
фогрупп красителей с положительно заряженными аминокислот-
ными остатками в белке. Затем оно, вероятно, закрепляется
ван-дер-ваальсовскими, водородными, а возможно, и гидрофоб-
ными связями.
Как уже упоминалось, для фиксации белковых полос окра-
шивание ведут в кислой среде. Какой бы буфер ни использовал-
ся при электрофорезе, к моменту окрашивания он замещается
на довольно крепкий раствор (10% и более) уксусной кислоты
или ТХУ, поэтому преимущественный заряд любого белка оказы-
вается положительным за счет остатков лизина, аргинина и ги-
стидина, так что для белков используются преимущественно кис-
лые красители, несущие остатки сульфокислоты. Они сохраняют
свой отрицательный заряд и при низких значениях рН.
В прошлом десятилетии широко использовали «амидо-
шварц»—краситель с фирменным названием «Amido Black 10B»
(сейчас его выпускают под названием «Naphthalene Black 12B»).
Его растворяли до концентрации 1% в 7%-ном растворе уксус-
ной кислоты. В настоящее время его вытеснил другой краси-
тель—кумасси ярко-голубой («Coomassie brilliant blue», сокра-
щенно СВВ). Этот краситель дает лучшую чувствитель-
ность и линейную зависимость интенсивности окраски от концент-
рации белка в более широком ее диапазоне. Краситель выпус-
кают в двух модификациях: R-250 и G-250. Здесь для ориенти-
ровки приведена структурная формула второго из них. Структура
СВВ R-250 отличается только отсутствием двух метальных групп.
Фирма BDH сейчас выпускает эти красители под названиями
«PAGE blue 83» и «PAGE blue G-90» соответственно.
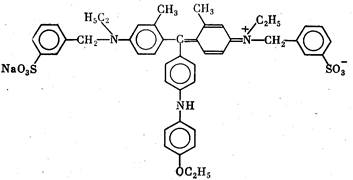
Кумасси G-250
Обилие ароматических колец в структуре красителей типа
СВВ делает их плохо растворимыми не только в воде, но и в раз-
бавленной уксусной кислоте. Для улучшения растворимости к
кислоте часто добавляют метанол. Обычно используют водные
растворы, содержащие 9—10% уксусной кислоты и 40—45% ме-
танола (по объему), однако рабочая концентрация СВВ R-250 в
этой смеси составляет 0,1—0,25%, реже 0,5%. Иногда СВВ R-250
растворяют в 25%-, 50%-ной ТХУ или в смеси, содержащей
10% ТХУ и 25% изопропанола (остальное—вода). Возможны
и другие варианты, не меняющие существа дела: краситель дол-
жен полностью раствориться в кислом растворителе, осаждаю-
щем белок. Не растворившиеся примеси следует отфильтровать.
Их наличие не. говорит о плохом выборе растворителя, так как
Препараты красителя, изготавливаемые для промышленных це-
лей, редко бывают чистыми.
Продолжительность окрашивания зависит от толщины и по-
ристости геля и может варьировать от 2—3 до 12 ч. Для ускоре-
ния процесса можно окрашивать гель при 37°, а ванночку с рас-
створом красителя покачивать. Отмывку от не связавшегося с
белком красителя ведут, как описано выше, например вымачи-
вая гель в 7%-ной уксусной кислоте или в смеси, содержащей
7,5% уксусной кислоты и 5% метанола. В этих условиях раство-
римость красителя достаточна для вымывания его свободных
молекул, а десорбция его с белка незначительна. Если электро-
форез вели в присутствии высокой концентрации мочевины, то лучше отмывать смесью, содержащей 7,5% уксусной кислоты и
20% метанола.
Гель из трубки отмывают в пробирке, пластину геля— в ван-
ночке. При окрашивании соотношение объемов жидкости и геля
должно составлять примерно 3:1, при отмывке — 5:1 или даже
10: 1 с двумя-тремя сменами растворителя. Если в растворитель
добавлена ионообменная смола, то его менять не нужно. Отмыв- ку можно вести поперечным электрофорезом, как подробно опи-
сано выше.
Окрашенный гель из трубки можно сканировать в специаль-
ном приборе или с помощью приставки, которой комплектуются
сейчас многие продажные спектрофотометры. Не следует, впро-
чем, слишком полагаться на соотношение размеров пиков такой
электрофореграммы при оценке количественного соотношения
белков в полосах, так как связывание красителя зависит не толь-
ко от концентрации, но и от химического состава и конформации
белка.
Если электрофорез проводили в кварцевых трубках, то гели
можно сканировать, не извлекая их из трубок, по ультрафиоле-
товому поглощению белков (или нуклеиновых кислот, что значи-
тельно легче).
В этом случае необходимо тщательно очищать или перекри-
сталлизовывать акриламид для уменьшения его собственного
поглощения в ультрафиолетовой области спектра.
Другая возможность количественной регистрации электрофо-
реграммы заключается в денситометрировании его фотографии.
В этом случае ошибка в оценке истинного соотношения коли-
честв белка в полосах может еще усугубиться за счет нелиней-
ности чувствительности фотопленки и других особенностей фото-
графического процесса.
Наиболее надежным способом количественных измерений яв-
ляется счет радиоактивности в белковых полосах при условии
однородности радиоактивной метки по всем компонентам смеси и обеспечения полноты выхода счета, о чем будет подробнее ска-
зано ниже.
После окрашивания СВВ R-250 можно качественно, но впол-
не надежно обнаружить полосу, содержащую 10 мкг белка.На
порядок более высокую чувствительность окраски можно полу-
чить с помощью красителя СВВ G-250. Для этого используют
относительно плохую его растворимость в хлорной кислоте. Го-
товят 0,04%-ный коллоидный раствор красителя в 3,5%-ном вод-
ном растворе НС104, фильтрованием освобождаются от крупных,
не растворившихся частиц. В полученном коричневом растворе
вымачивают гель в течение 1,5 ч при комнатной температуре.
Сорбция на белке сдвигает равновесие в сторону диссоциации
коллоидных частиц; краситель связывается с белком и окраши-
вает его в синий цвет (коричневая окраска была обусловлена
наличием коллоидных частиц). На геле при этом краситель не
сорбируется. Синеватые полосы белка проступают на бледно-ко-
ричневом фоне геля уже через 30 мин. По истечении 1,5 ч гель
переносят в 5%-ный раствор уксусной кислоты. Интенсивность
окраски полос при этом увеличивается, а фон становится проз-
рачным и светло-голубым — часто его можно не отмывать [Hoi-
brook, Leaver, 1976]. Описан и другой вариант использования
СВВ G-250: его растворяют сначала в 1 н. H2S04, а затем в
12%-ной ТХУ [Blakesley, Boezi, 1977].
Для окрашивания гистонов после электрофореза иногда
используют краситель «Fast green FCF» [McMaster-Kaye, Kaye,
1974]. Его можно использовать и для других белков. Он менее
чувствителен, чем СВВ, но более надежен для количественных
оценок содержания белка в полосах путем денситометрирования,
так как при отмывке геля СВВ в большей степени, чем «Fast
green», вымывается из белковых полос, причем инойраз неоди-
наково для различных белков [Bertolini et al., 1976].
Следует отметить, что в случае плотных белковых полос при
недостаточной продолжительности окрашивания можно столк-
нуться с артефактом — возникновением «двойной полосы». На
самом же деле это одна полоса, интенсивно окрашенная с двух
своих торцевых поверхностей.
Во всех описанных способах белки перед окрашиванием или
в его процессе фиксируют осаждением кислотой и спиртом.
Однако некоторые основные белки (например, рибонуклеаза и
протамин), а также низкомолекулярные пептиды и гормоны при
такой обработке не осаждаются, а, наоборот, растворяются и
вымываются из геля. Недавно был предложен принципиально
иной подход к фиксации белков и пептидов в геле после электро-
фореза. Гель в течение 1 ч вымачивают в 5%-ном растворе фор-
мальдегида в 25%-ном этаноле с добавлением СВВ R-250 до
0,11%. В этих условиях формальдегид ковалентно сшивает пеп-
тиды с матрицей геля за счет образования метиленовых мости-
ков между аминогруппами аминокислот и первичными аминами
ПААГ. На приведенных в работе фотографиях можно видеть ра-
зительный эффект обнаружения щелочных и низкомолекулярных
белков: гели, кажущиеся пустыми при обычном окрашивании, на
самом деле содержат множество белковых полос. Гели с ДДС-Na
красят более продолжительное время (до 3 ч) в 3,5%-ном рас-
творе формальдегида, что обеспечивает вытеснение ДДС-Na
красителем. Отмывку гелей ведут в течение ночи в 3,5%-ном рас-
творе формальдегида в 25%-ном этаноле [Steck et al., 1980].
Дата добавления: 2015-10-21; просмотров: 1536;
