Лидирующие красители
Для наблюдения за ходом электрофореза в исходный препа-
рат вносят краситель, мигрирующий в том же направлении, что
и фракционируемые белки. Он не должен заметным образом свя-
зываться с белками, а скорость его продвижения по гелю долж-
на быть заведомо больше, чем у наиболее быстро мигрирующего
белка. Вместе с тем краситель не должен слишком сильно от-
рываться от белков, чтобы его прохождению до конца пласти-
ны или трубки соответствовало использование большей части
находящегося в них геля для фракционирования белков. Быть
может, по ассоциации с велосипедными гонками за лидером, этот
краситель называют лидирующим («tracker dye»).
В щелочных и нейтральных буферах, когда кислые белки за-
ряжены отрицательно и мигрируют к аноду, а также для любых
белков в комплексе с ДДС-Na (см. ниже) используют отрица-
тельно заряженные красители. Наибольшее распространение по-
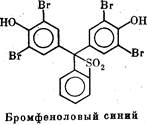
лучил бромфеноловый синий, имеющий достаточно сложную
структуру; в его состав, в частности, входят два дибромфеноль-
ных остатка. Иногда используют еще более сложно построен-
ный краситель — ксиленцианол, электрофоретическая подвиж-
ность которого примерно вдвое ниже, чем бромфенолового сине-
го, поэтому его используют при фракционировании крупных бел-
ков и нуклеиновых кислот.
Для характеристики электрофоретической подвижности бел-
ка в данных условиях электрофореза принято указывать отно-
шение расстояния, пройденного белковой полосой от начала ра-
бочего геля, к аналогичному расстоянию до полосы красителя
в этом же геле. Это отношение, как и в хроматографии, обозна-
чают Rf.
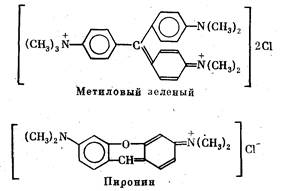
В качестве положительно заряженного красителя для элект-
рофореза в кислой среде, когда белки мигрируют в направлении
катода, используют метиловый зеленый или пиронин.
РАЗДЕЛЕНИЕ БЕЛКОВ ПО РАЗМЕРАМ И ЗАРЯДУ
В этом случае в электродных резервуарах и для полимериза-
ции ПААГ используют один и тот же буфер, поэтому такую си-
стему иногда называют непрерывной, или простой. Строго гово-
ря, непрерывность нарушается тем, что буфер, в котором вносят
белковый препарат, с целью концентрирования исходной зоны
разбавляют в 5 — 10 раз водой.
Подбор оптимальных условий электрофореза сводится к вы-
бору следующих параметров: пористости геля и степени его
сшивки, т. е. значений Т и С (см. главу 1); природы, концентра-
ции и рН буфера; диссоциирующих добавок (если это необхо-
димо); максимально допустимой мощности, напряжения и силы
тока, а также продолжительности разделения; объема и кон-
центрации исходного препарата; процедуры предварительной об-
работки препарата.
Выбор значений T и С в зависимости от молекулярных масс
разделяемых белков был подробно обоснован в главе 1. Чаще
всего с белками работают при T = 3,5 — 20 и C = 1 — 3.
Дата добавления: 2015-10-21; просмотров: 1608;
