Цетавлон
Цетилтриметиламмонийбромид (цетавлон) — положительно
заряженный ионный детергент. Как известно, ДДС-Na раство-
ряет не все щелочные белки, зато хорошо растворяет нуклеино-
вые кислоты, которые могут создавать помехи при электрофоре-
зе белков, входящих в состав нуклеопротеидов. Паним и соавто-
ры предложили заменить ДДС-Na на цетавлон [Panyim et al.,
1977]. Как и ДДС-Na, цетавлон способствует растворению бел-
ков за счет связывания с гидрофобными участками полипепти-
дов. Благодаря электростатическому отталкиванию положитель-
но заряженных аммониевых групп цетавлона белковые цепи рас-
прямляются и приобретают жесткость. Комплекс белка с цетав-
лоном, особенно в кислой среде, заряжен заведомо положитель-
но. Вместе с тем цетавлон взаимодействует с нуклеиновыми
кислотами как «жирный катион» и осаждает их из, раствора.
Использование цетавлона имеет и свои трудности. При взаи-
модействии с персульфатом аммония он довольно легко выпадает
в осадок, поэтому полимеризацию геля приходится вести при
слегка повышенной температуре (37°), в термостате. Кроме то-
го, цетавлон осаждает красители типа СВВ R-250, поэтому окра-
шивание геля ведут при температуре 80—100°.
Паним и соавторы для разделения смеси стандартных белков использова-
ли 10%-ный ПААГ (С=1,5), полимеризованный в 0,09 М Na-ацетатном буфе-
ре (рН 4,6) с 0,09% цетавлона. Примерно таким же буфером заполняли элек-
тродные резервуары. Исходный препарат готовили, растворяя белки до кон-
центрации 0,25—0,5 мг/мл в 0,0.1 М Na-ацетатном буфере (рН 4,6) с 0,5%
цетавлона и 1% р-меркаптоэтанола. Назначение последнего — такое же, как
при обработке белков ДДС-Na. Белковый раствор кипятили 5 мин или инку-
бировали 2 ч при 37°, а затем добавляли мочевину до концентрации 6 М. На
трубку (10x0,6 см) вносили 20 мкл раствора препарата (5—10 мкг белка).
Электрофорез вели при силе тока 8—10 мА на гель и напряженности поля
8—10 В/см. В качестве лидирующего красителя использовали 0,05%-ный рас-
твор Azure А. Белки окрашивали 0,25%-ным раствором СВВ R-250 в 10%-ной
уксусной кислоте, содержащей 45% метанола, в течение 30—60 мин при тем-
пературе 80—100°. Отмывали излишек красителя в 0,9 М уксусной кислоте
при той же температуре.
Как и при электрофорезе с ДДС-Na, в случае обработки це-
тавлоном также наблюдается линейная зависимость между ло-
гарифмом молекулярной массы белка и расстоянием его мигра-
ции в геле. Пользуясь этой зависимостью, удается оценивать
молекулярные массы белков в интервале 15—90 тыс. дальтон.
Эли и соавторы недавно предложили модификацию описан-
ной выше системы [Ely et al., 1979J. Они заменили персульфат
аммония на флавинмононуклеотид (ФМН) в качестве инициа-
тора полимеризации, которая идет при освещении (ФМН рас-
творим лучше, чем рибофлавин). Это снимает проблему осаж-
дения цетавлона при полимеризации геля.
В качестве рабочего буфера геля использовали U,l М Na-фосфат (рН'7)
с 0,l% цетавлона. Белковый препарат перед электрофорезом денатурировали
в течение 1 мин на кипящей водяной бане в том же буфере, но содержащем
0,5% цетавлона и 10—15% р-меркаптоэтанола. Лидирующий краситель-
малахитовый зеленый. Электрофорез в 10%-ном ПААГ при силе тока 8 мА на
трубку (10x0,6 см) занимал около 5 ч. Белки фиксировали в кипящей 10%-
ной ТХУ, затем окрашивали при комнатной температуре 0,5%-ным раствором
СВВ R-250 в 10%-ной уксусной кислоте, содержащей 4'5% этанола, в течение
10ч.
Обработку цетавлоном удобно использовать для диссоциа-
ции белков от ДНК в хроматине с одновременным осаждением
ДНК и последующим электрофорезом комплексов белков с це-
тавлоном. При низких значениях рН связывание цетавлона с ги-
стонами и негистоновыми белками хроматина носит избиратель-
ный характер, что способствует их электрофоретическому раз-
делению.
Фракционирование белков по степени их гидрофобности мож-
но преобразовать в разделение по заряду с помощью следующе-
го приема [Helenius, Simons, 1977]. Для исключения роли раз-
меров белков электрофорез ведут в 1%-ной агарозе, растворен-
ной в 0,05 М глициновом буфере с 0,1 М NaCI и 0,5% Тритона
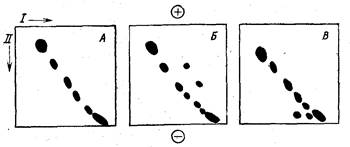
Рис. 27. Обнаружение гидрофобных белков двумерным электрофорезом «со
сдвигом заряда» [Bhakdi et al., 1977]
А — без дополнительных детергентов; Б — с добавлением ДОХ; В—с добавлением це-
тавлона
Х-100 с добавлением в него либо цетавлона до 0,5%, либо дез-
оксихолата натрия (ДОХ) до 0,25%. Тритон Х-100 образует
мицеллы, которые связываются с гидрофобными участками бел-
ка в количестве, пропорциональному размеру этих участков.
Цетавлон или ДОХ объединяются с Тритоном Х-100 в смешан-
ные мицеллы, привнося тем самым в комплекс с белком соответ-
ственно положительный или отрицательный заряд, существенно
превышающий собственный заряд белка. При электрофорезе
белки мигрируют со скоростью, обусловленной знаком и вели-
чиной привнесенного заряда. Такой прием можно назвать «элек-
трофорезом со сдвигом заряда». Необычное введение в буфер
геля 0,1 М NaCl по-видимому, способствует как растворимости
белков, так и образованию, мицелл. Напряженность поля при
этом приходится снижать до 4,5 В/см.
Аналогичный подход был использован для обнаружения гид-
рофобных белков в двумерном варианте электрофореза [Bhakdi
et al., 1977]. Разделение белков в первом направлении (I) вели
в 1%-ной агарозе с 0,5% Тритона Х-100. Вырезали полоску, пе-
реносили ее в форму, куда заливали такой же раствор агарозы,
но с добавлением цетавлона или ДОХ. После электрофореза во
втором направлении (II) все гидрофильные белки ложились на
диагонально расположенную прямую, а гидрофобные выпадали
из нее (рис. 27).
Комбинация электрофореза в кислой мочевине с Тритоном
Х-100 в первом направлении и такой же системы, но с цетавло-
ном вместо Тритона, во втором позволила Боннеру и соавторам
выявить значительное число дополнительных фракций при раз-
делении гистонов двумерным электрофорезом. В обоих направ-
лениях использовалась система ступенчатого электрофореза
(3,3%-ный ПААГ—формирующий, 15 %-ный— рабочий). По-
лимеризацию вели с рибофлавином. После электрофореза в пер-
вом направлении белки фиксировали и окрашивали СВВ. При
этом отпадала необходимость вести электрофорез во втором на-
правлении немедленно по окончании первого разделения И обе-
спечивалась возможность оценить качество последнего. Цетав-
лон, который вносили в верхний электродный буфер (0,15%),
мигрируя под действием поля через полоску препарата, снова
растворял белки и освобождал их от красителя. Во избежание
образования дисульфидных мостиков в раствор красителя для
геля первого направления добавляли до 0,1% цистамина. Для
предупреждения фотоокисления гистонов гели держали вдали
от яркого света [Bonner et al., 1980].
В заключение отметим, что при электрофорезе мембранных
липопротеидов главная проблема связана с их растворением.
Даже в 1%-ном ДДС-Na при 100° не удается добиться надеж-
ного растворения. Между тем липопротеиды хорошо растворя-
ются в смеси 6 г глицина и 10 мл 98%-ной муравьиной кислоты.
Электрофорез можно вести в 13 М НСООН (50%). Для этого
полимеризуют гель в воде, потом его вынимают, вымачивают в
13 М НСООН и с каплей глицерина вставляют в трубку, диа-
метр которой на 0,1—0,2 мм больше, чем у той, которая исполь-
зовалась при полимеризации. В ней и ведут электрофорез [Mok-
rasch, 1978]. В другом варианте электрофореза водонераствори-
мых белков в качестве рабочего буфера геля использовали смесь
фенола, этиленгликоля и воды в соотношении 3:2:3 (масса/объ-
ем/объем). Мономерный акриламид реагирует с фенолом, по-
этому полимеризацию ПААГ в пластинах проводили опять-таки
в водной среде, которую затем путем вымачивания геля заменя-
ли описанной выше смесью [Pusztai, Watt, 1973].
Дата добавления: 2015-10-21; просмотров: 1888;
