ДВУМЕРНЫЙ ЭЛЕКТРОФОРЕЗ В ПААГ
Полное разделение сложной смеси белков далеко не всегда
удается осуществить в ходе одного опыта даже с применением
описанных выше приемов повышения разрешающей способно-
сти электрофореза в ПААГ. Всегда достаточно высока вероят-
ность того, что в данной системе электрофореза различные бел-
ки мигрируют в одной зоне либо в силу близости их размеров,
либо ввиду совпадения значений их электрофоретических под-
вижностей при выбранном значении рН, либо, наконец, в ре-
зультате неблагоприятной для разделения комбинации этих
параметров. Поэтому в сложных случаях каждую полосу после
первого электрофоретического фракционирования смеси бел-
ков следует проверить на гомогенность, используя ее как исход-
ный препарат для электрофореза в других условиях. Это можно
сделать одновременно для всех полос первого разделения, или,
как его часто называют, «разделения в первом направлении».
Для этого трубку или полоску, вырезанную по всей длине трека
из пластины первого направления, накладывают на стартовую
зону пластины «второго направления». Контакт между двумя
гелями обеспечивают, заливая место их соприкосновения стар-
товым буфером или, для надежности, расплавленным раствором
агарозы в этом же буфере. Электрофорез ведут в направлении,
перпендикулярном длине трубки или полоски. Каждая негомо-
генная белковая полоса может дать несколько пятен, если при
новых условиях электрофореза подвижности первоначально об-
разовавших ее нескольких белков окажутся неодинаковыми.
В результате на пластине второго направления после прокра-
шивания выявляется картина распределенных по всей поверх-
ности пятен, напоминающая «фингерпринт» в двумерной тонко-
слойной хроматографии. Число пятен, которое удается разли-
чить на одной пластине, в некоторых случаях приближается к
двум тысячам (!).
При сочетании гелей двух направлений вовсе не обязательно,
чтобы они были одинаковой толщины. Например, гель из труб-
ки диаметром 6 мм вполне можно совместить с пластиной толщи-
ной 1 мм. Для этого в месте перехода от трубки к пластине сле-
дует образовать продольно расположенную полость, предпочти-
тельно клиновидного сечения, куда можно заложить цилиндрик
геля и залить'его там буфером, агарозой или даже заполиме-
ризовать в переходный, крупнопористый ПААГ. Способ образо-
вания и форма сечения этой полости не играют большой роли.
Необходимо выполнить только одно условие: цилиндрик или по-
лоска геля первого направления должны лежать параллельно
краю геля в пластине второго направления. Можно, например,
воспользоваться простым вкладышем из плексигласа (рис. 23).
Этот вкладыш легко монтируется в обычный прибор для элек-
трофореза в вертикальной пластине [Hoffman, Dowben, 1978a].
Иногда из цилиндрика вдоль его продольной оси вырезают пло-
ский, тонкий слой и накладывают его на гель второго направ-
ления, как и полоску трека, вырезанную из пластины. Для вы-
резания плоского слоя из трубки (в замороженном состоянии)
удобно воспользоваться простым приспособлением, описанным
Уоттсом и др. [Watts et al., 1977].
В каждом из направлений двумерного электрофореза ис-
пользуют одну из рассмотренных выше систем, отвечающую спе-
цифическим особенностям фракционируемых белков. Широкое
применение двумерный электрофорез нашел, например, для
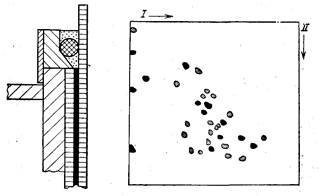
Рис. 23. Вкладыш из плексигласа для двумерного электрофореза [Hoffman,
Dowberi, 1978a]
Рис. 24. Результаты двумерного электрофореза рибосомальных белков [Mets,
Bogorad, 1974]
I—первое направление; II—второе направление
анализа белков рибосом из разных источников. Это, в основном,
слабощелочные белки, и в первом направлении их разделяют ча-
ще всего по заряду. Для этого используют крупнопористый гель,
чтобы различие молекулярных размеров по возможности не
сказывалось на разделении белков в этом направлении, т. е. не
накладывалось на разделение по заряду. Во втором направле-
нии в этом случае белки разделяют по их размерам.
Так, Мете и Богорад электрофорез рибосомальных белков в
первом направлении проводили в трубках диаметром 4 мм и
длиной 10 см [Mets, Bogorad, 1974]. 4%-ный ПААГ полимери-
зовали в буфере с рН 5. При этом все рибосомальные белки за-
ряжены положительно и различия значений их суммарных за-
рядов выражены наиболее ярко. В буфер вводили 8 М мочевину,
чтобы помешать агрегации белков. При полимеризации геля
вносили больше ТЕМЕД, чем персульфата аммония (0,1 и
0,03%), так как в кислой среде каталитическая активность
ТЕМЕД понижена (см. главу 2). 0,1—0,2 мг смеси рибосомаль-
ных белков вносили растворенными в 8 М мочевине с 10 мМ ди-
тиотреитолом. Разделение вели при силе тока 1,5 мА на трубку
в течение 4—5 ч. Во втором направлении использовали ступен-
чатый электрофорез. Рабочим гелем служил 10%-ный ПААГ,
полимеризованный в буфере с рН 6,75. Формирующий гель—
такой же, как гель первого направления (4% ПААГ, рН 5). Его
полимеризовали вокруг геля из трубки, уложенного в клиновид-
ное расширение над пластиной. Концентрацию мочевины в этом
геле снизили до 7 М, чтобы цилиндрик не мог всплыть во время
полимеризации. В качестве медленно мигрирующего иона верх-
него электродного буфера использовали MES (2-(N-морфолино-
этенсульфокислоту) — продажный препарат для составления
буферов с рКа 6,15. Быстрым ионом служил остаток уксусной
кислоты. В состав верхнего буфера ввели также 1% ДДС-Na и
0,01% тиогликолевой кислоты, которая, как уже упоминалось,
служит для очистки гелей от остаточных свободных радикалов
персульфата аммония. Она мигрирует из электродного буфера
в гель, где и движется впереди белков. Отметим, что преэлек-
трофорез в ступенчатой системе невозможен—он нарушил бы
распределение ионов по ступеням. Однако его можно провести
предварительно, использовав в качестве верхнего обычный бу-
фер с быстро мигрирующим ионом, а затем заменить его, как
описано выше. Верхний электрод является катодом, анод рас-
положен внизу. Под действием поля ДДС-Na из верхнего элек-
тродного буфера мигрирует в гель. В цилиндрике геля первого
направления он образует комплексы с белками. Далее отрица-
тельно заряженные комплексы белок — ДДС-Na выходят из ци-
лкндрика и фракционируются ступенчатым электрофорезом в
пластине. Обработка белков ДДС-Na, таким образом, 'происхо-
дит в отсутствие b-меркаптоэтанола. Его отчасти заменяет мо-
чевина; кроме того, исходно, до электрофореза в первом направ-
лении, белки восстанавливают 10 мМ дитиотреитолом. Электро-
форез во втором направлении ведут в течение 5 ч при силе тока
25 мА на пластину. Метод удобен тем, что между разделениями
в первом и втором направлениях нет надобности вымачивать
гель, так как буфер геля первого направления—тот же, что и у
формирующего геля второго направления. Результаты электро-
фореза представлены на рис. 24.
В другой работе [Howard, Traut, 1973] разделение рибосо-
мальных белков по заряду в первом направлении вели тоже в
4%-ном ПААГ в присутствии 6 М мочевины, но в 0,4 М Трис-
боратном буфере, рН 8,7. При этом рН часть белков рибосом
оказывается заряженной отрицательно, а другая часть—поло-
жительно. Белковый препарат смешивали с расплавленной
1%-ной агарозой и вносили в середину трубки, наслаивая его
на заполимеризованный нижний участок ПААГ. После затвер-
девания агарозы в трубку заливали новую порцию смеси моно-
меров и полимеризовали верхний участок ПААГ. При этом в
интересах концентрирования полос на обеих границах с ПААГ
агарозу с белковым препаратом полимеризовали в разбавлен-
ном (0,06 М) Трис-боратном буфере. При включении напряже-
ния миграция белков шла в обе стороны—к катоду и аноду.
Во втором направлении разделение белков вели по их размерам,
но без обработки ДДС-Na. Для этого использовали пластину
еще. более мелкопористого геля, чем в предыдущей работе (T=
=18,25; С=1,37), полимеризованного в 0,9 М уксусной кисло-
те, титрованной КОН до рН 4,5, также с добавлением 6 М моче-
вины. В этом случае все белки были заряжены положительно и
мигрировали к катоду. В качестве лидирующего красителя ис-
пользовали 0,1%-ный раствор пиронина. Из цилиндрика геля
вдоль его продольной оси вырезали плоскую полоску, вымачи-
вали ее в 0,013 М К-ацетатном буфере (рН 5,2) с 8 М мочеви-
ной. Полоску зажимали между стеклянными пластинками фор-
мы и прямо на нее заливали раствор мономеров рабочего геля.
Катионом верхнего электродного буфера служил глицин
(~0,19 М), титрованный уксусной кислотой до рН 4. Таким об-
разом, осуществлялась система ступенчатого электрофореза,
где в качестве быстрого иона выступал К+, а медленного—гли-
цин. Отметим, что в системе Орнстейна и Дэвиса глицин фигу-
рировал в качестве медленного аниона, а здесь он служил ка-
тионом. Возможность такого двоякого использования вытекает
из цвиттерионной природы глицина. Формирующим гелем в этой
системе служила сама полоска, вырезанная из геля первого на-
правления. Аналогичная система двумерного электрофореза ри-
босомальных белков описана и в другой работе [Sherton, Wool,
1974]. .
Гамильтон [Hamilton, 1974] при разделении рибосомальных
белков по заряду в первом направлении использовал ступенча-
тый электрофорез в кислом буфере (7,5%-ный ПААГ с рН 4,6—
в рабочем геле, 2,5%-ный ПААГ с рН 6,5—в формирующем).
Во втором направлении он вел разделение белков в комплексе
с ДДС-Na в 15%-ном ПААГ. Обработку детергентом он осуще-
ствлял, вымачивая извлеченный из трубки гель первого направ-
ления в 1%-ном растворе детергента. В работе были определены
молекулярные массы рибосомальных белков (путем сравнения
с маркерами во втором направлении) и оценены их количествен-
ные соотношения в составе малой субъединицы рибосом печени
крысы.
Интересный подход к фракционированию рибосомальных
белков был использован в недавней работе [Hoffman, Dowben,
1978b]. При разделении в первом направлении авторы исполь-
зовали различие в протяженности гидрофобных участков по-
верхности у разных белков рибосомы. Оно проявлялось в степе-
ни связывания этих белков с мицеллами Тритона Х-100, который
вводили при полимеризации геля до концентрации 0,15%. Ком-
плексы белков с Тритоном Х-100 разделяли по размеру в 8%-ном
ПААГ в присутствии 2 М мочевины. Концентрация детергента
была оптимальной; при меньших концентрациях он мало влияет
на подвижность белков, а при больших, как уже отмечалось,
препятствует последующей обработке ДДС-Na, который в этой
работе использовали при фракционировании белков во втором
направлении. Подробнее об использовании Тритона Х-100 в этих
целях будет сказано в следующем разделе.
В качестве лидирующего красителя при фракционировании
рибосомальных белков в кислом буфере недавно было предло-
жено использовать FeCl3. Ионы Fe3+ в присутствии уксусной
кислоты образуют стойкие комплексы коричневого цвета, миг-
рирующие к катоду впереди самого мелкого из рибосомальных
белков [Bernabeu et al., 1979].
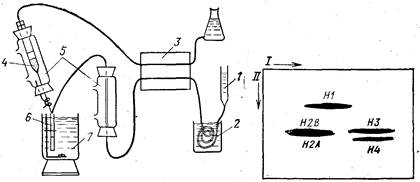
Рис. 25. Сочетание хроматографии с электрофорезом в геле агарозы fBloom,
Anderson, 1979]
1 — хроматографическая колонка; 2—обессоливавие в «биофибрах», 3 — перистальтиче-
ский насос; 4— раствор агарозы; 5 — нагреватели; 6— трубка для электрофореза; 7—
охлаждающая смесь
Рис. 26. Разделение гистонов сочетанием хроматографии на оксиапатите (на-
правление I) и электрофореза в градиенте концентрации ПААГ (направление
II) в присутствии ДДС-Na [Bloom, Anderson, 1979]
Двумерным электрофорезом часто разделяют и другие ще-
лочные белки. Например, факторы инициации белкового синте-
за из ретикулоцитов образуют много пятен при фракционирова-
нии каждого из них в первом направлении по заряду в кислой
мочевине, а во втором—по размерам ступенчатым электрофо-
резом в системе Лэммли [Floyd et al., 1979].
Двумерный электрофорез белков хроматина описан Бакае-
вым и соавторами (Bakayev et al., 1978]. В первом направлении
хроматин после обработки его микрококковой нуклеазой фрак-
ционировали в 5%-ном ПААГ и буфере низкой ионной силы
(0,01 М ТЭА-НС1, рН 7,6) на олиго-, моно- и субнуклеосомы за
счет заряда входящей в их состав ДНК, как это было описано
выше. Во втором направлении авторы использовали в одном
случае фракционирование белков хроматина по размеру в си-
стеме Лэммли после вымачивания геля первого направления в
1%-ном растворе ДДС-Na. Детергент обеспечивал и диссоциа-
цию белков от ДНК. В другом варианте разделения диссоциа-
цию осуществляли с помощью цетавлона, а электрофорез во
втором направлении вели в кислой мочевине. Во втором вариан-
те хорошо выявлялась группа быстро мигрирующих негистоно-
•вых белков хроматина (HMG-белков). Для анализа этих белков
авторы экстрагировали их 0,35 М раствором Nad, очищали
осаждением ТХУ (2—20%) и разделяли двумерным электрофо-
резом, причем в первом направлении использовали фракциони-
рование по заряду в кислой мочевине, а во втором — разделение
по размерам в 15%-ном ПААГ после обработки ДДС-Na.
Двумерный электрофорез субъединиц различных РНК-поли-
мераз в уже цитированной работе д'Алессио и соавторов про-
водили в двух вариантах разделения белков по заряду в первом
направлении. В обоих вариантах использовали ступенчатую си-
стему электрофореза: в одном—с кислым буфером (рН 4,3) для
рабочего геля, в другом—со щелочным (рН 9,4). Во втором на-
правлении в обоих случаях белки фракционировали по их раз-
мерам после обработки ДДС-Na в системе Лэммли [d'Alessio et
al., 1979].
Мы не случайно в качестве примеров двумерного электрофо-
реза рассмотрели только случаи фракционирования щелочных
белков. Для кислых белков все другие варианты двумерного
фракционирования вытеснила уже упоминавшаяся система
О'Фарелла. Щелочные белки до последнего времени плохо раз-
делялись в этой системе, однако недавно была предложена ее
модификация, позволяющая успешно вести разделение и щелоч-
ных белков.
Блум и Андерсон предложили оригинальный метод двумер-
ного разделения белков [Bloom, Anderson, 1979]. Собственно,
электрофорез в нем используется только во втором направле-
нии. Фракционирование белков в первом «направлении» осуще-
ствляется на хроматографической колонке (рис. 25). Элюат с
колонки обессоливают, пропуская его через «биофибры», погру-
женные в 10%-ный раствор ДДС-Na с 1% b-меркаптоэтанола.
Затем его подогревают до 96° и по каплям смешивают с раство-
ром расплавленной при такой же температуре агарозы. Оба
раствора подают одним двухканальным перистальтическим на-
сосом, и горячая смесь постепенно заполняет погруженную в лед
трубку. Таким образом, в трубке полимеризуется элюат с хро-
матографической колонки, т. е. по длине геля располагаются
белковые зоны в той последовательности, как они выходят из
колонки. Затем гель извлекают из трубки и накладывают на
пластину ПААГ, заливают расплавленной агарозой и ведут
электрофорез в системе Лэммли. В частности, авторы элюирова-
ли гистоны с колонки оксиапатита линейным градиентом кон-
центрации NaCl (0—1,5 М) в 1 мМ Na-фосфатном буфере
(рН 6) с 6 М мочевиной. Гистоны выходили, не разделившись,
а лишь растянувшись по элюату. Во втором направлении ис-
пользовали электрофорез в присутствии ДДС-Na в градиенте
пористости ПААГ (8—25%). На пластине гистоны оказались
прекрасно отделенными друг от друга (рис. 26). В частности,
гистоны Н2А и Н2В далеко отошли от НЗ благодаря значитель-
ному различию в их сродстве к оксиапатиту.
Исходный препарат в такой постановке опыта может быть
и не элюатом с колонки, а реакционной смесью, в которой со
временем происходят изменения белкового состава, например
в результате протеолиза. Маркерные белки с известной молеку-
лярной массой можно прикалывать при заполнении трубки так,
что их положение по ее длине будет заведомо определенным.
ЭЛЕКТРОФОРЕЗ С ИСПОЛЬЗОВАНИЕМ
ТРИТОНА Х-100 И ЦЕТАВЛОНА
Дата добавления: 2015-10-21; просмотров: 2195;
