Характерные реакции аллил- и пропенилфенолов
Являясь многофункциональными соединениями, аллил- и пропенилфенолы проявляют свойства соответствующих классов органических соединений.
При наличии свободной ОН-группы они взаимодействуют со щелочами, образуя растворимые в воде феноляты. На этой реакции основан промышленный способ выделения эвгенола из гвоздичного и других эфирных масел.
Ацетальная группа в молекулах сафрола, миристицина и др. делает эти соединения неустойчивыми к действию водных растворов кислот вследствие гидролиза ацеталей:
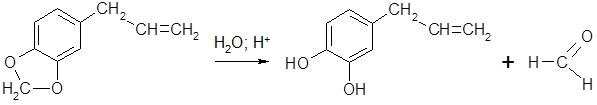
В щелочной среде ацетальная группа устойчива.
Характерной реакцией боковой углеводородной цепи является перегруппировка аллильного радикала в изопропенильный, протекающая при нагревании со щелочами (реакция Фаворского), например:
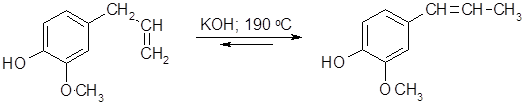
эвгенол изоэвгенол (Z- и Е-изомеры)
Равновесие реакции смещено вправо в связи с большей термодинамической стабильностью молекулы изоэвгенола, где двойная связь пропенильного радикала находится в сопряжении с ароматическим ядром. Превращение эвгенола в изоэвгенол может осуществляться также под действием катализаторов на основе Ru, Rh и Fe(CO)5.
Аналогичная перегруппировка протекает и с другими аллильными производными – хавиколом и сафролом. При этом образуются анетол, обладающий большей ценностью, чем хавикол, и изосафрол, являющийся промежуточным прродуктом при получении гелиотропина из сафрола. Данные перегруппировки широко используют в промышленных масштабах.
Наличие двойной связи в боковой цепи придает аллил- и пропенилфенолам свойства алкенов. Они присоединяют галогены, родан (SCN)2 и водород, гидроксилируются по Вагнеру слабым раствором KMnO4. Гидроксилирование анетола дает анетолгликоль, дегидратация которого приводит к анискетону, являющемуся одним из характерных минорных компонентов анисового масла:
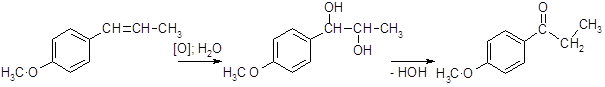
анетол анетолгликоль анискетон
Изоэвгенол склонен к димеризации, которая включает электрофильное присоединение по двойной связи и электрофильное замещение в бензольном кольце. Реакция катализируется кислотами:
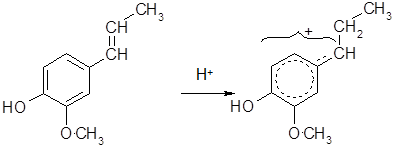
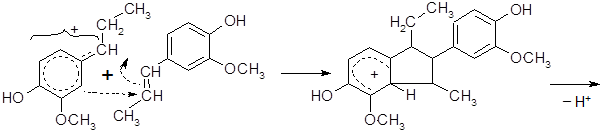
σ-комплекс
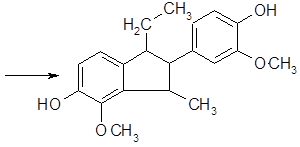
диизоэвгенол
Димеризация изоэвгенола снижает его устойчивость при хранении.
Наличие в молекулах многих из рассмотренных соединений метоксигруппы определяет их принадлежность к классу простых алкил-ариловых эфиров. Характерной реакцией простых эфиров является реакция разложения данных соединений галогеноводородными кислотами, среди которых наиболее активна HJ:

Рекцию с HJ применяют для количественного определения метокси-групп в продуктах, содержащих анетол, эвгенол, гваякол, ванилин и др. В этих целях образующийся иодметан отгоняют из реакционной массы, улавливают и определяют иод реакцией с нитратом серебра (метод Цейзеля) или иными методами.
1.5.2.4 Получение аллил- и пропенилфенолов
Из рассмотренных соединений наибольшее практическое значение имеют анетол, эвгенол, изоэвгенол и сафрол, которые получают в промышленных масштабах.
Получение анетола осуществляют следующими методами: вымораживанием или вакуум-ректификацией анетолсодержащих эфирных масел; изомеризацией метилхавикола, содержащегося в кубовых остатках ректификации скипидара; химическим синтезом из анизола и пропионового ангидрида.
Основное количество имеющегося на мировом рынке анетола получают изомеризацией метилхавикола, присутствующего в небольших количествах в североамериканском скипидаре. Хотя содержание метилхавикола в нем невелико, большие объемы производства скипидара создают достаточную сырьевую базу для удовлетворения основных потребностей в анетоле на мировом рынке. Изомеризацию метилхавикола осуществляют по реакции Фаворского действием спиртового раствора гидроксида калия. Образующийся анетол относят к полусинтетическим душистым веществам, в отличие от натурального анетола, выделяемого из эфирных масел.
Синтетический анетол получают из химического сырья, осуществляя следующие реакции:
- ацилирование анизола пропионовым ангидридом в присутствии хлорида железа (III) с образованием пара-метоксипропиофенона:
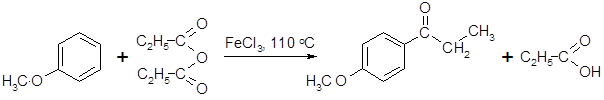
анизол пара-метоксипропиофенон
Реакция относится к процессам электрофильного замещения в ароматическом ядре ( SE ) и протекает быстро, поскольку в бензольном кольце анизола имеется активный донорный заместитель. В присутствии FeCl3, проявляющего умеренную активность в качестве кислоты Льюиса, замещение происходит, в основном, в пара-положение;
- восстановление полученного кетона до спирта гидрированием с использованием катализатора на основе меди и хрома:
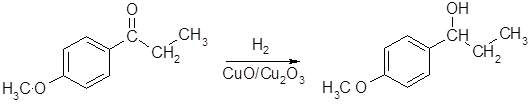
1-(пара-метоксифенил)пропанол
Использование катализатора на основе оксидов металлов позволяет осуществить гидрирование карбонильной группы с высокой селективостью и избежать насыщения бензольного кольца;
- дегидратация 1-(пара-метоксифенил)пропанола в присутствии KHSO4:
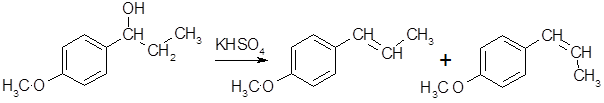
Е-анетол Z-анетол
Образующиеся при дегидратации изомеры анетола разделяют высокоэффективной ректификацией с последующей изомеризацией Z-анетола в Е-изомер нагреванием с KHSO4.
Основным источником получения эвгенола являются эфирные масла. Эвгенол выделяют из эфирных масел, используя растворимость в воде фенолятов, образующихся при обработке масел растворами щелочей.
Изоэвгенол получают из эвгенола реакцией Фаворского. Известен также метод получения изоэвгенола химическим синтезом из гваякола и пропионового ангидрида по следующей схеме:
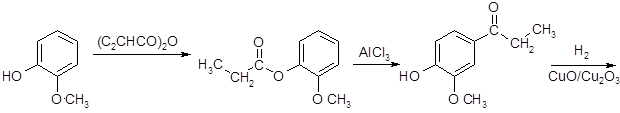
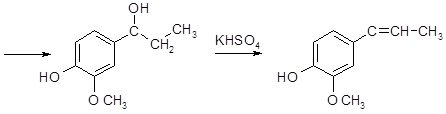
изоэвгенол
(смесь Z- и Е-изомеров)
Данный процесс похож на синтез анетола, причем последние две стадии полностью идентичны. Отличие заключается в проведении ацилирования ароматического ядра пропионовым ангидридом. В синтезе изоэвгенола ацилирование осуществляют в две ступени: сначала ацилируют фенольную группу с получнием сложного эфира (эта реакция протекает очень легко), а затем полученный сложный эфир изомеризуют в пропиофенон. Стадия изомеризации сложных эфиров фенолов в гидроксифенилкетоны протекает в присутствии кислот Льюиса и известна в органической химии как перегруппировка Фриса.
Получение сафрола осуществляют вакуумной ректификацией сассофрасового или камфорного масел.
Дата добавления: 2015-09-29; просмотров: 3942;
