Реакции простых фенолов
Химические свойства рассматриваемых соединений определяются их принадлежностью к классу фенолов.
Тимол, карвакрол, гваякол, как и все фенолы, проявляют свойства кислот и реагируют со щелочами с образованием растворимых в воде фенолятов.
В отличие от спиртов не реагируют с карбоновыми кислотами с образованием сложных эфиров. Сложные эфиры могут быть получены только действием на фенолы ангидридов или галоидангидридов кислот.
Как и другие фенолы, тимол, карвакрол и гваякол образуют простые эфиры при взаимодействии с галоидалкилами и другими соединениями, содержащими галоген при насыщенном атоме углерода (синтез Вильямсона). Реакция протекает в щелочной среде по механизму нуклеофильного замещения. Фенолят-анион, образующийся под действием щелочи, является активным нуклеофилом и способен быстро замещать анион галогена с образованием простых алкилариловых эфиров. Подобным образом протекает реакция тимола и карвакрола с хлоруксусной кислотой:
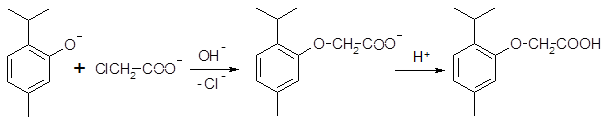
2-изопропил-5-метилфеноксиуксусная кислота
Реакция с хлоруксусной кислотой специфична для фенолов. Образующиеся производные являются кристаллическими веществами и используются для идентификации фенолов по температурам плавления. Температуры плавления феноксиуксусных кислот тимола и карвакрола равны соответственно 148 и 151 0С.
Характерные для ароматических соединений реакции электрофильного замещения (SE) в молекулах рассматриваемых фенолов протекают особенно легко, что связано с активированием бензольного ядра донорными заместителями. Подобные реакции осуществляют в ряде синтезов душистых веществ, где сырьем является гваякол, а также в аналитических целях. Так, реакция с диазосоединениями, приводящая к образованию ярко окрашенных продуктов, используется для качественного определения фенолов в эфирных маслах, а одна из методик определения тимола основана на реакции замещения водорода роданом (CNS)2; реакция протекает быстро и полностью заканчивается в течение 1 часа с образованием монороданида.
Фенолы склонны к окислению кислородом воздуха. Процесс протекает через образование арилоксирадикалов, где неспаренный электрон делокализован за счет сопряжения с π – системой бензольного ядра:
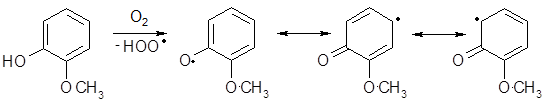
Рекомбинация радикалов приводит к димерам с возникновением преимущественно углерод-углеродной связи:
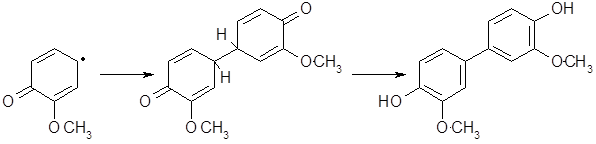
Димеры имеют протяженную систему сопряжения и оказываются окрашенными соединениями, что объясняет потемнение фенолов и фенолсодержащих эфирных масел при хранении.
Бензольное кольцо тимола, карвакрола, гваякола, как и других фенолов, хорошо восстанавливается водородом над никелевым катализатором до соответствующих циклогексанолов. На этом основано промышленное получение ментола гидрированием тимола:
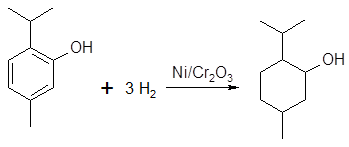
ментол
(смесь изомеров)
Реакция протекает не стереоспецифично, и продукт гидрирования представляет собой смесь пространственных изомеров ментола с преобладанием (±) – ментола (до 55 %).
 Сам тимол получают алкилированием мета-крезола пропеном в присутствии мета-крезолята алюминия. Мета-крезол весьма активен в реакциях алкилирования, поскольку оба донорных заместителя активируют одинаковые положения в бензольном ядре (действуют согласованно); замещение водорода может происходить в любом из трех активированных положений. Мета-крезолят алюминия, являющийся, как и хлорид алюминия (наиболее распространенный катализатор реакций SE), типичной кислотой Льюиса, отличается тем, что ориентирует замещение, в основном, в орто-положение по отношению к фенольной группе. Как предполагают, орто-алкилирование происходит при взаимодействии пропилена не с мета-крезолом, а с мета-крезолятом алюминия; мета-крезол вступает во взаимодействие на последующих ступенях процесса. Механизм реакции представляют следующим образом:
Сам тимол получают алкилированием мета-крезола пропеном в присутствии мета-крезолята алюминия. Мета-крезол весьма активен в реакциях алкилирования, поскольку оба донорных заместителя активируют одинаковые положения в бензольном ядре (действуют согласованно); замещение водорода может происходить в любом из трех активированных положений. Мета-крезолят алюминия, являющийся, как и хлорид алюминия (наиболее распространенный катализатор реакций SE), типичной кислотой Льюиса, отличается тем, что ориентирует замещение, в основном, в орто-положение по отношению к фенольной группе. Как предполагают, орто-алкилирование происходит при взаимодействии пропилена не с мета-крезолом, а с мета-крезолятом алюминия; мета-крезол вступает во взаимодействие на последующих ступенях процесса. Механизм реакции представляют следующим образом:
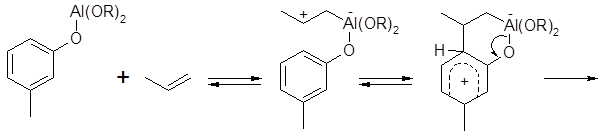
s-комплекс
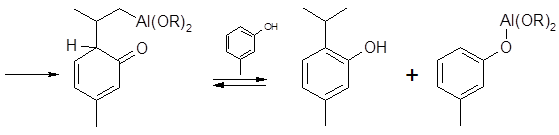 ,
,
Хотя тимол оказывается основным продуктом процесса (его доля в реакционной массе составляет около 50 %), в заметных масштабах (до 5 %) образуются изомеры тимола - продукты алкилирования по другим положениям бензольного кольца. Еще одним нежелательным побочным процессом, типичным для реакций алкилирования ароматических соединений, является повторное алкилирование с образованием дизамещенных продуктов. Это обясняется дополнительным активированием бензольного ядра после введения нового донорного заместителя – изопропильного радикала. Содержание продуктов двойного алкилирования при промышленном осуществлении ппроцесса достигает 12 %.
1.5.2 Аллил– и пропенилфенолы и их производные
Фенолы, содержащие в боковой цепи аллильный или пропенильный радикалы, представлены рядом распространенных душистых и биологически активных веществ, многие из которых обладают высокой парфюмерной ценностью.
1.5.2.1 Одноатомные аллил– и пропенилфенолы и их производные
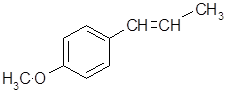 К данной группе фенолов относятся хавикол, метилхавикол и анетол. Наибольшее значение имеет анетол, С10Н12О, MR 148,2. Анетол встречается в природе в виде Z- и Е-изомеров. Преобладает Е-изомер; Z-анетол выступает как минорная нежелательная примесь к Е-анетолу.
К данной группе фенолов относятся хавикол, метилхавикол и анетол. Наибольшее значение имеет анетол, С10Н12О, MR 148,2. Анетол встречается в природе в виде Z- и Е-изомеров. Преобладает Е-изомер; Z-анетол выступает как минорная нежелательная примесь к Е-анетолу.
Е-Анетол представляет собой бесцветную жидкость с запахом аниса и сладким вкусом. При пониженных температурах кристаллизуется; температура плавления кристаллов 21,5 – 23 0С. Растворим в этаноле и других органических растворителях; плохо растворим в воде. Является главным компонентом анисового (до 95 %), бадьянового (до85 %), фенхелевого (50 – 80 %) эфирных масел. Применяется в парфюмерных композициях и отдушках для зубных средств, для ароматизации алкогольных напитков, как сырье для получения анисового альдегида и некоторых лекарственных препаратов.
Z-Анетол отличается резким неприятным запахом, жгучим вкусом и заметной токсичностью (в 20 раз токсичнее Е-изомера). Практического значения не имеет. При нагревании с КНSO4 изомеризуется в Е-анетол.
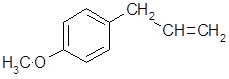 Метилхавикол(эстрагол), являясь аллильным изомером анетола, сопутствует ему в анисовом, бадьяновом, фенхелевом маслах, где его доля достигает 2 - 7 %. В некоторых эфирных маслах метилхавикол выступает в качестве главного компонента. Так, в масле эстрагона его доля достигает 60 %, а в масле базилика метилхавикольного типа – 85 %. Представляет собой бесцветную жидкость с анисовым запахом; по качеству запаха и вкуса уступает анетолу. Сильный антисептик.
Метилхавикол(эстрагол), являясь аллильным изомером анетола, сопутствует ему в анисовом, бадьяновом, фенхелевом маслах, где его доля достигает 2 - 7 %. В некоторых эфирных маслах метилхавикол выступает в качестве главного компонента. Так, в масле эстрагона его доля достигает 60 %, а в масле базилика метилхавикольного типа – 85 %. Представляет собой бесцветную жидкость с анисовым запахом; по качеству запаха и вкуса уступает анетолу. Сильный антисептик.
Хавикол менее распространен в природе по сравнению с анетолом и 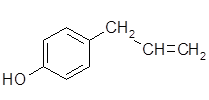 метилхавиколом. В наибольших количествах (10 – 12 %) он присутствует в байевом масле (из листьев тропического дерева Pimenta racemosa). Обладает бактерицидным и фунгицидным действием. Как индивидуальное душистое вещество используется редко.
метилхавиколом. В наибольших количествах (10 – 12 %) он присутствует в байевом масле (из листьев тропического дерева Pimenta racemosa). Обладает бактерицидным и фунгицидным действием. Как индивидуальное душистое вещество используется редко.
Дата добавления: 2015-09-29; просмотров: 2736;
