Реакции ароматических альдегидов
Перечисленные ароматические альдегиды обладают всеми характерными свойствами данного класса органических соединений. Они вступают в реакции нуклеофильного присоединения (AN) по карбонильной группе с такими известными нуклеофилами, как производные аммиака, гидросульфит натрия, спирты и др.
Реакция с гидроксиламином протекает быстро и до конца, что позволяет использовать ее, как и в случае терпеновых альдегидов, для количественного определения ароматических альдегидов.
Реакция с гидросульфитом натрия приводит к образованию кристаллических или растворимых в воде гидроксисульфоновых производных и находит применение для выделения альдегидов из смесей. Например, реакцию бензальдегида с NaHSO3 в промышленности проводят в целях очистки бензилового спирта от примесей бензальдегида, для чего бензиловый спирт обрабатывают раствором NaHSO3, переводя бензальдегид в водную фазу в виде гидроксисульфонового соединения.
Коричный альдегид, являясь α, β-ненасыщенным альдегидом, образует два продукта присоединения. При мольном соотношении NaHSO3 и альдегида 1:1 образуется нерастворимый в воде кристаллический продукт присоединения по альдегидной группе:
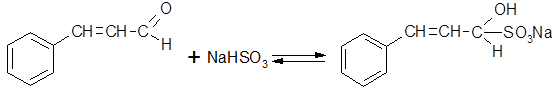
Двойное количество гидросульфита приводит к присоединению NaHSO3 не только по альдегидной группе, но и по α, β-двойной связи:
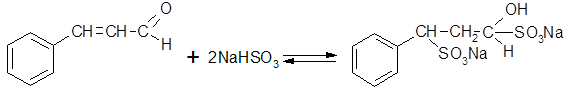
Образующееся дисульфосоединение растворимо в воде, что используют при выделении коричного альдегида из эфирных масел (процесс аналогичен выделению цитраля - α,β-ненасыщенного терпенового альдегида; см. 3.7.3 пособия /1/).
Реакция со спиртами приводит к образованию соответствующих ацеталей, многие из которых обладают парфюмерными достоинствами и применяются в качестве душистых веществ. Особенно распространены ацетали фенилацетальдегида – диметилацеталь, глицеринацеталь, обладающие цветочным запахом с оттенками розы и гиацинта. Реакция ФАА с глицерином приводит к смеси двух изомеров с пяти- и шестизвенным ацетальным циклом:
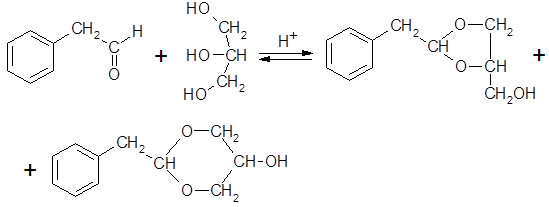
Ацетали ФАА более устойчивы при хранении, чем сам фенилацетальдегид.
Окисление альдегидов приводит к соответствующим кислотам. Бензальдегид легко окисляется кислородом воздуха по механизму цепного радикального автоокисления, аналогично окислению бензилового спирта (см. 1.2.5.1). Подобным же образом ведет себя коричный альдегид, который на воздухе постепенно превращается в коричную кислоту. Здесь зарождение цепи происходит так же легко, как и у бензальдегида в связи с эффективной стабилизацией возникающего радикала 1 за счет эффекта сопряжения:
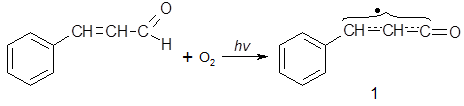
Гидрокоричный альдегид к автоокислению устойчив, поскольку образование сопряженного радикала, аналогичного 1, невозможно.
Как известно, реакции оксосоединений протекают не только за счет карбонильной группы. Вторым реакционным центром в молекулах альдегидов и кетонов является α-звено при наличиив нем атомов водорода. Сильное акцепторное действие карбонильной группы придает атомам водорода α-звена протонную подвижность, и карбонильное соединение выступает в качестве СН-кислоты. Одной из характерных реакций, протекающих с участием α-звена, является реакция конденсации карбонильных соединений. Карбонильные соединения, относящиеся к СН-кислотам, в щелочной среде претерпевают конденсацию с образованием димеров, тримеров и т. д., вплоть до смол. Из рассмотренных ароматических альдегидов к подобному превращению способны ФАА и гидрокоричный альдегид. Наиболее активен в этом отношении ФАА, от α-звена которого особенно легко отщепляется протон, поскольку на α-звено воздействуют одновременно карбонильная группа и бензольное кольцо. Это приводит к эффективной стабилизации образующегося под действием катализатора (щелочи) интермедиата 1 и облегчает протекание реакции:
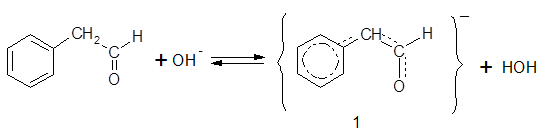
Карбанион 1, являясь активным нуклеофилом, присоединяется по карбонильной группе другой молекулы ФАА с образованием димера 2, который при взаимодействии с новым анионом 1 дает тример, и т. д.:
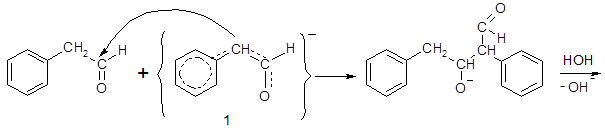
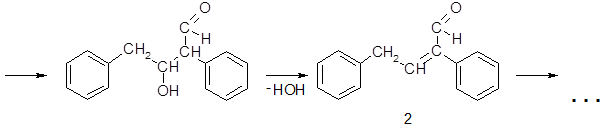
Бензальдегид и куминовый альдегид к подобным превращениям неспособны, поскольку в α-звене их молекул отсутствуют атомы водорода. Эти альдегиды не подвергаются конденсации в щелочной среде, но нагревание с концентрированными растворами щелочей вызывает их диспропорционирование (реакция Канниццаро). Бензальдегид в подобных условиях образует бензиловый спирт и соль бензойной кислоты:
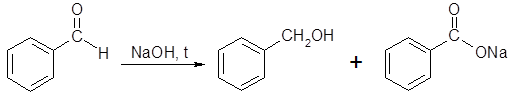
Устойчивость в слабощелочной среде делает бензойный и куминовый альдегиды удобными объектами для проведения перекрестной конденсации с другими оксосоединениями. Например, конденсацией бензальдегида с уксусным альдегидом получают коричный альдегид:
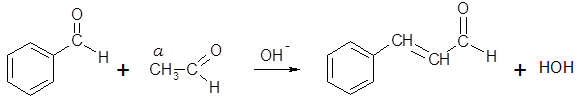
Взаимодействием бензальдегида с бутаналем (масляным альдегидом) с последующим селективным гидрированием продукта конденсации получают 2-бензилбутаналь (апельсиналь) – душистое вещество с цветочно-цитрусовым запахом:
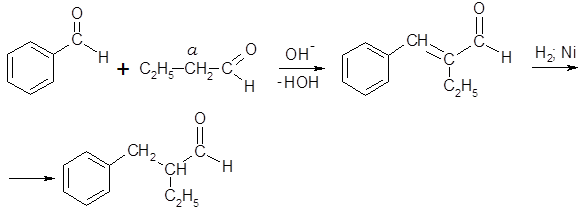
апельсиналь
Конденсация куминового альдегида с пропаналем и гидрирование продукта конденсации приводит к образованию цикламенальдегида, обладающего сильным запахом, похожим на запах цветов цикламена:
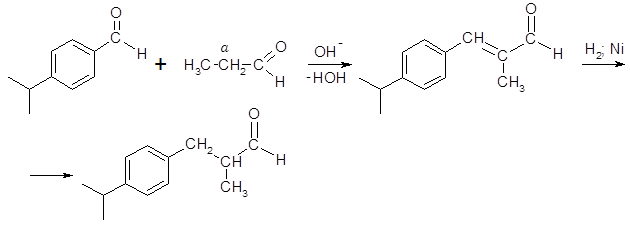
цикламенальдегид
Известен и ряд других синтезов подобного рода.
Среди других характерных свойств рассматриваемых альдегидов следует отметить неустойчивость ФАА при хранении. Этот альдегид быстро полимеризуется в стеклообразную массу без запаха. Реакция похожа на поликонденсацию в щелочной среде, но в данном случае интермедиатом является не анион, а радикал 1, зарождающийся под действием кислорода и стабилизированный сопряжением с карбонильной группой и бензольным ядром:
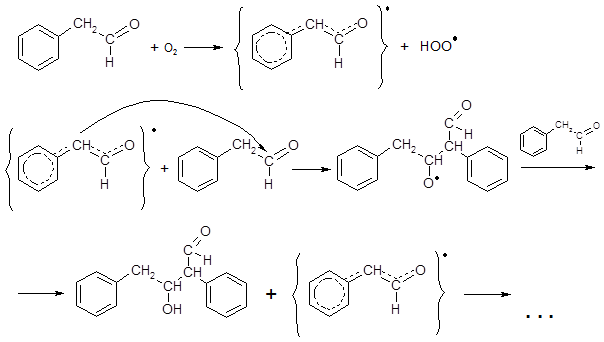
димер
Производимый промышленностью ФАА хранят в присутствии антиоксидантов или растворяют в диэтилфталате, бензиловом, фенилэтиловом и других спиртах.
Дата добавления: 2015-09-29; просмотров: 9352;
