Опыт 1. Применение уравнения изотермы химической реакции для определения направления процесса
1. Пользуясь справочными данными по константам образования различных комплексов железа(III), напишите процессы образования шести различных комплексных соединений, образованных ионами железа Fe3+ и роданид-ионами SCN–. Напишите выражения для ступенчатых констант образования и их значения. Напишите выражения для общих констант образования, их значения и процессы им соответствующие.
| Лиганд | 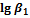
| 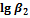
| 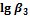
| 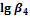
| 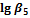
| 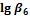
|
| SCN– | 3,03 | 4,33 | 4,63 | 4,53 | 4,23 | 3,23 |
| Cl– | 1,48 | 1,78 | 0,78 | –0,85 | – | – |
| F– | 6,04 | 10,74 | 13,74 | 15,74 | 16,10 | >16,10 |
2. Сделайте вывод о наиболее устойчивом комплексном соединении в растворе. Основываясь на этом выводе, напишите уравнение реакции, исходя из KSCN и FeCl3 в молекулярном и ионном виде. Напишите выражение константы равновесия Кс для данного процесса и ее значение.
3. Напишите выражение изотермы химической реакции через текущие концентрации компонентов исследуемой системы. Каково соотношение между величинами Пс и Кс в условиях равновесия для данного раствора?
4. Налейте в пробирку 3 мл раствора из колбы № 1, содержащего 0,001М Fe3+ и 0,020 М SCN–. Добавьте в пробирку 7 мл раствора из колбы № 2, содержащего 0,001 М Fe3+. Как изменилось при этом в растворе общее содержание железа СFe и роданида СL? Каким стало соотношение СL/СFe?
5. Как изменилось значение комплекса текущих концентраций Пc в момент добавления раствора № 2: уменьшилось или увеличилось? Каким стало соотношение в этот момент между Пс и Кс, какой знак (> 0 или < 0) приобрела величина DrG? В какую сторону произошло смещение равновесия? Сделанные выводы подтвердите расчетом.
6. Используя принцип Ле Шателье–Брауна, объясните наблюдаемые изменения.
Пробирку с полученным раствором сохраните для последующих опытов (пробирка № 1).
Дата добавления: 2015-09-29; просмотров: 1037;
