Опыт 4. Смещение равновесия и конкурирующие лигандообменные процессы
1. В две пробирки № 7и № 8 добавьте по 5 мл раствора из колбы № 1 (CL = 0,020 моль/л, CFe = 0,001 моль/л). В пробирку № 7 добавьте 5 мл 0,02 М раствора KCl, в пробирку № 8 добавьте 5 мл 0,02 M раствора KF. Что наблюдаете?
2. Используя справочные данные (опыт 1), сравните устойчивость роданидных, хлоридных и фторидных комплексов железа. Происходит ли образование хлоридных комплексов в растворе пробирки № 7? Основываясь на принципе Ле Шателье–Брауна, объясните наблюдаемые в пробирке № 7 изменения.
3. Определите наиболее устойчивый фторидный комплекс железа(III), напишите реакцию его образования, исходя из [Fe(SCN)3] и KF в молекулярном и ионном виде. Запишите через равновесные концентрации выражение для константы равновесия Кс этого процесса, а также выразите ее через известные величины общих констант образования роданидного и фторидного комплексов, приведите численное значение константы равновесия. Рассчитайте равновесный состав раствора пробирки № 8.
Теоретические вопросы
1.Дайте качественную характеристику термодинамического равновесия закрытой системы, в которой протекает химическая реакция.
2. Как можно определить, что в системе наступило равновесие?
3. Выразите константу равновесия реакции АВ(г) = А(г) + B(г) через степень диссоциации АВ и давление.
4. Выведите соотношения между Кр и Кс для равновесия: 2SО2(г) + О2(г)  2SО3(г).
2SО3(г).
5. Преобразуйте соотношение ΔG° = ΔH° – TΔS° = –RТlnK тaк, чтобы было видно, как температура влияет на константу равновесия.
6. Предложите способ расчёта ΔG°, ΔН° и ΔS° на основе известных значений констант равновесия исследуемой химической реакции при двух температурах.
7. Константа равновесия некоторой реакций при 293 К равна 5·10-3, а при 1000 К составляет 2 ·10-6. Определите (без расчётов) знак ΔН этой реакции.
8.При повышении температуры давление в системе 2СО + О2 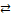 2СО2 повышается. Определите знак изменения энтальпии реакции.
2СО2 повышается. Определите знак изменения энтальпии реакции.
9. Для каких из указанных реакций уменьшение объёма сосуда приведёт к смешению равновесия в том же направлении, что и понижение температуры?
а) N2(г) + О2(г) 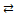 2NO(г), ΔН > 0;
2NO(г), ΔН > 0;
б) СО2(г) + С(т) 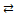 2СО(г), ΔН > 0;
2СО(г), ΔН > 0;
в) 2СО(г) + О2(г) 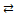 2СО2(г), ΔН < 0;
2СО2(г), ΔН < 0;
г) СО(г) + Н2О(г) 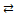 СО2(г) + Н2(г), ΔН < 0.
СО2(г) + Н2(г), ΔН < 0.
10. Написать выражения константы равновесия для следующих реакций, протекающих по уравнениям:
а) FeO(т) + Н2(г)  Fe(т)+ Н2О(г);
Fe(т)+ Н2О(г);
б) 2СO(г) 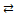 С(т) + О2(г);
С(т) + О2(г);
в) 2Сu(т) + O2(г) 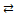 2СuО(т).
2СuО(т).
Дата добавления: 2015-09-29; просмотров: 1508;
