Опыт 2. Приготовление растворов различной интенсивности окрашивания и расчет равновесного состава растворов по константам устойчивости
1. В дополнение к раствору в пробирке № 1 с соотношением СL/СFe= 6 приготовьте еще четыре раствора с соотношением СL/СFe= 8, 10, 14 и 20 (пробирки № 2, 3, 4 и 5). Для этого смешайте растворы из колб № 1 и № 2 в соотношении 4 мл/6 мл, 5 мл/5 мл, 7 мл/3мл и 10 мл/0 мл. Вы получите в пробирках серию растворов с цветовой гаммой от светлого буро-желтого до темного кирпично-красного. Интенсивность окрашивания раствора определяется концентрацией комплексных ионов Fe (SCN)n3–n.
2. Составьте таблицу для расчета равновесного состава изучаемой системы. Вводя следующие обозначения: [Fe3+] – равновесная концентрация ионов железа в растворе; CFe – общая концентрация железа в растворе; [L] – равновесная концентрация роданид-ионов; CL – общая концентрация лиганда в растворе; [FeLn] – равновесная концентрация комплекса в растворе, выведите в общем виде выражение для расчета [FeLn]. Так как в изучаемой системе присутствует избыток лиганда, то [L] ≈ CL. Проведите расчет равновесного состава растворов пробирок № 1–5.
3. Составьте таблицу равновесных составов растворов.
| Номер пробирки | СL, моль/л | [Fe(SCN)3],моль/л | [Fe3+], моль/л |
4. Отметьте корреляцию изменения интенсивности окрашивания растворов с изменением концентрации комплексного соединения. Которая из концентраций: СL,[Fe(SCN)3] или [Fe3+] изменяется наиболее сильно? Наиболее медленно?
Опыт 3. Определение теплового эффекта образования комплексного соединения Fe (SCN)3 по уравнению изобары химической реакции
В небольшом интервале температур от Т1 до Т2, принимая тепловой эффект реакции постоянным, DrH = const, можно определить величину DrH с помощью уравнения, полученного после интегрирования изобары:
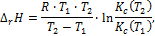
где 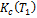 и
и 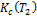 –константы устойчивости при Т1 и Т2 соответственно.
–константы устойчивости при Т1 и Т2 соответственно.
Налейте в пробирку № 6 5 мл раствора из колбы № 1 (CL = 0,020 моль/л, CFe = 0,001 моль/л). Измерьте температуру раствора Т1. Сравните раствор № 6 по цвету с раствором № 5. Поместите пробирку № 6 в химический стакан емкостью 250 мл с нагретой до 45–50°С водой. Поместите термометр в пробирку и закрепите его в штативе. После того как раствор в пробирке № 6 прогреется до 42–45°С, запишите температуру раствора Т2. Измерения температуры производить с точность до 0,1°С.
Уберите термометр из пробирки, пробирку из воды и, сравнивая по цвету посветлевший раствор № 6 с растворами № 1–5, определите концентрацию [Fe(SCN)3] в подогретом растворе, используя таблицу равновесных составов из опыта 2. Изменение цвета раствора при нагревании происходит в результате изменения концентрации комплексного соединения, от 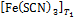 до
до 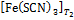 , поэтому
, поэтому
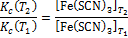
Рассчитайте величины отношения 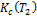 /
/ 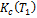 , а затем тепловой эффект реакции
, а затем тепловой эффект реакции 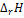 . Экзо- или эндотермической является реакция?
. Экзо- или эндотермической является реакция?
С помощью уравнения изобары химической реакции (4.22)–(4.25) объясните наблюдаемое смещение равновесия при увеличении температуры.
Дата добавления: 2015-09-29; просмотров: 1378;
