Общая константа образования

Ступенчатая константа образования

Легко показать, что
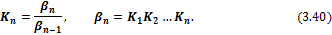
Процесс комплексообразования, как любой ступенчатый процесс, подчиняется общим закономерностям: каждая последующая ступень идет в меньшей степени, чем предыдущая и значения характеризующих их констант в большинстве случаев уменьшается. Это объясняется влиянием ряда факторов: а) возрастанием пространственных затруднений при увеличении числа лигандов, если они обладают большими размерами, чем молекулы воды; б) электростатическим расталкиванием в случае заряженных лигандов.
Соединения, включающие комплексный катион или анион, ведут себя в водном растворе как сильные электролиты (первичная диссоциация комплекса). При этом происходит необратимая диссоциация на комплексные ионы и ионы, составляющие внешнюю сферу, например:
K2[HgBr4] = 2K+ + HgBr42–.
Затем происходит вторичная диссоциация комплекса уже по типу слабого электролита – внутренняя сфера комплекса в водном растворе обратимо подвергается акватации. При этом лиганды последовательно замещаются на молекулы воды:
[MLn] + H2O  [MLn –1(H2O)] + L
[MLn –1(H2O)] + L
(заряды частиц опущены). Равновесная концентрация воды здесь – величина постоянная (вода – растворитель), поэтому при рассмотрении равновесий в водных растворах комплексов молекулы воды при записи часто опускают. Покажем на примере рассмотренного ранее комплекса последовательный поцесс акватации:
| Ступень | Равновесие | Ступенчатая константа нестойкости |
| IV | [HgBr4]2– + H2O 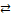 [HgBr3H2O]– + Br–
упрощенно HgBr42– [HgBr3H2O]– + Br–
упрощенно HgBr42– 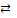 HgBr3– + Br– HgBr3– + Br–
| 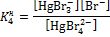
|
| III | [HgBr3H2O]– + H2O 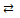 [HgBr2(H2O)2] + Br–
упрощенно HgBr3– [HgBr2(H2O)2] + Br–
упрощенно HgBr3– 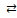 HgBr2 + Br– HgBr2 + Br–
| 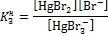
|
| II | [HgBr2(H2O)2] + H2O 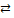 [HgBr(H2O)3]+ + Br–
HgBr2 [HgBr(H2O)3]+ + Br–
HgBr2 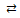 HgBr+ + Br– HgBr+ + Br–
| 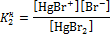
|
| I | [HgBr(H2O)3]+ + H2O 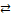 [Hg(H2O)4]2+ + Br–
HgBr+ [Hg(H2O)4]2+ + Br–
HgBr+  Hg2+ + Br– Hg2+ + Br–
| 
|
Константы 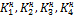 – называются ступенчатыми константами нестойкости (неустойчивости). Общая константа нестойкости равна произведению ступенчатых констант:
– называются ступенчатыми константами нестойкости (неустойчивости). Общая константа нестойкости равна произведению ступенчатых констант:
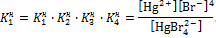
Данное выражение отвечает гипотетическому равновесию:
HgBr42– 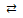 Hg2+ + 4Br–.
Hg2+ + 4Br–.
Константа образования – обратная величина константе нестойкости:

Чтобы ступенчатые константы образования и ступенчатые константы нестойкости соответствовали друг другу, нумерацию ступеней вторичной диссоциации комплексных частиц дают в обратном порядке.
Константы образования и нестойкости характеризуют устойчивость комплексных частиц: чем больше константа образования (меньше константа нестойкости), тем более устойчива комплексная частица, и наоборот. Знание констант устойчивости комплексов позволяет рассчитывать равновесные концентрации частиц в растворах, проводить сравнительную оценку прочности комплексов и т. д.
Устойчивость комплексов зависит от прочности химической связи между комплексообразователем и лигандами и определяется рядом факторов, таких как природа комплексообразователя, лиганда, растворителя.
Использование констант образования комплексов позволяет отличать их от солей. Комплексы и соли по-разному ведут себя в водных растворах: соли диссоциируют необратимо на катионы и онионы, а в комплексах происходит обратимое замещение лигандов на молекулы воды, характеризуемое соответствующими константами. Так, FeCl3 относится к солям
FeCl3 = Fe3+ + 3Cl–,
поскольку для FeCl3 β3 ≈ 6, и в разбавленных водных растворах диссоциация практически необратима.
В то же время [Fe(NCS)3] – комплексное соединение:
[Fe(NCS)3] 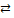 Fe3+ + 3NCS–; β3 ≈ 105.
Fe3+ + 3NCS–; β3 ≈ 105.
Задание к работе
1. Определить направление процесса в неравновесной системе с помощью изотермы химической реакции.
2. Рассчитать состав равновесной смеси ионов в растворе, используя значения констант равновесия.
3. Определить отношение констант равновесия при температурах Т2, Т1 и рассчитать тепловой эффект процесса образования комплексного соединения, используя уравнение изобары реакции.
Дата добавления: 2015-09-29; просмотров: 3496;
