Равновесия в водных растворах комплексных соединений
ТЕРМОДИНАМИКА ХИМИЧЕСКОГО РАВНОВЕСИЯ ПРОЦЕССОВ КОМПЛЕКСООБРАЗОВАНИЯ
Равновесия в водных растворах комплексных соединений
Комплексообразование – ступенчатый процесс, каждая ступень характеризуется константой равновесия, которая называется константой образования комплекса, часто используется термин константа устойчивости.
Так, например, в растворе, содержащем ионы Ag+ и Br–, имеют место следующие равновесия (для простоты в выражениях для равновесных концентраций квадратные скобки при написании формул комплексных частиц опускаются):
| Ступень | Равновесие | Ступенчатая константа образования | Значение ступенчатой константы |
| I | Hg2+ + Br– 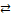 HgBr+ HgBr+
| 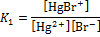
| 1,12·109 |
| II | HgBr+ + Br– 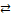 HgBr2 HgBr2
| 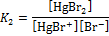
| 1,91·108 |
| III | HgBr2 + Br–  HgBr3– HgBr3–
| 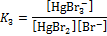
| 26,3 |
| IV | HgBr3– + Br–  HgBr42– HgBr42–
| 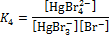
| 18,1 |
К1, К2, К3, К4 – ступенчатые константы образования комплексов характеризуют способность комплексообразователя к последовательному присоединению лигандов.
Общая константа образования βn характеризует устойчивость комплекса [MLn] иравна произведению ступенчатых констант образования:
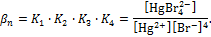
В справочной литературе чаще указывается значение lg 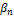 .
.
В общем виде для комплекса [MLn]
M + nL 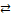 [MLn].
[MLn].
Дата добавления: 2015-09-29; просмотров: 905;
