Анодные процессы в водных растворах
| Анод | Анионы безкислородные | Анионы кислородсодержащие |
| Нерастворимый | Окисление аниона (кроме фторидов) Асm — +me = Ас0 | В щелочной среде
4ОН—— 4е = О2  + 2Н2О
В кислой, нейтральной средах
2Н2О — 4е = О2 + 2Н2О
В кислой, нейтральной средах
2Н2О — 4е = О2  + 4Н+ + 4Н+
|
| Растворимый | Окисление металла анода Ме0 —ne = Меn+ Анод раствор | Окисление металла анода Ме0 —ne = Меn+ Анод раствор |
Массу вещества, образовавшегося при электролизе найти исходя из закона Фарадея:
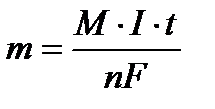 , где m - масса вещества, М – молярная масса, n - количество отданных или принятых электронов, F – число Фарадея (96500 Кл/моль) = А·ч/моль), I – сила тока (А), t - продолжительность процесса.
, где m - масса вещества, М – молярная масса, n - количество отданных или принятых электронов, F – число Фарадея (96500 Кл/моль) = А·ч/моль), I – сила тока (А), t - продолжительность процесса.
Электролиз используется для выделения и очистки металлов, получения щелочей, хлора, водорода. Алюминий, магний, натрий, кадмий получают только электролизом. Очистку меди, никеля, свинца проводят целиком электрохимическим методом. Для защиты от коррозии электрохимическим методом на поверхность металлических изделий наносится тонкий слой другого металла (хрома, серебра, меди, никеля, золота), устойчивого к коррозии.
Дата добавления: 2015-10-19; просмотров: 1093;
