ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
Электродвижущая сила гальванического элемента равна алгебраической сумме электродных потенциалов электродов.



Скачок потенциала, возникающий на границе раздела металл – раствор его соли, называется электродным или окислительно – восстановительным потенциало ( 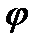 ). Зависимость электродного потенциала от природы металла, концентрации его ионов в растворе и температуры количественно выражается уравнением В. Нернста.
). Зависимость электродного потенциала от природы металла, концентрации его ионов в растворе и температуры количественно выражается уравнением В. Нернста. 
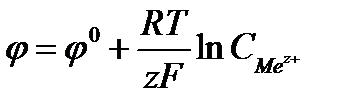 , где F - число Фарадея
, где F - число Фарадея
равно 96500Кл/моль, z – заряд иона, R – газовая постоянная 8,31Дж/моль·К, Т температура по Кельвину, 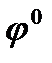 - стандартный электродный потенциал металла. Подставляя в формулу число Фарадея, температуру 298К, газовую постоянную и десятичный логарифм, получаем:
- стандартный электродный потенциал металла. Подставляя в формулу число Фарадея, температуру 298К, газовую постоянную и десятичный логарифм, получаем:
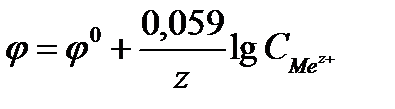
Стандартным электродным потенциалом металла 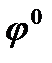 называется скачок потенциала на границе раздела металл - раствор его соли с концентрацией 1 моль/л.
называется скачок потенциала на границе раздела металл - раствор его соли с концентрацией 1 моль/л.
Для измерения электродных потенциалов собирают гальваническую цепь, состоящую из исследуемого электрода и стандартного водородного электрода. Водородный электрод представляет собой платиновую пластинку, насыщенную газообразным водородом, которая опущена в водный раствор кислоты. Потенциал стандартного водородного электрода принят равным нулю. Например: для цинкового электрода:
Zn|ZnSO4|| H2SO4 |H2,Pt
Потенциал цинкового электрода будет равен ЭДС такого гальванического элемента с обратным знаком, если берется медный электрод, то его потенциал будет равен ЭДС гальванического элемента.
Последовательность металлов, расположенных в порядке убывания (возрастания) значений их электродных потенциалов, называется рядом напряжения или рядом активности металлов. В гальванических элементах более активный металл является анодом (он растворяется при работе гальванического элемента), а менее активный катодом. Для расчета ЭДС гальванического элемента из потенциала менее активного металла отнимается потенциал более активного металла.
Например: стандартный потенциал цинкового электрода равен -0,76 В, медного 0,35В. ЭДС = 0,35 – (-0,76) = 1,11В.
Дата добавления: 2015-10-19; просмотров: 903;
