Основные уравнения химической термодинамики и химического равновесия
1. Q = DE + W -уравнение первого начала термодинамики
2. W = PDV –работа расширения
3. Qv = DEv -теплота изохорного процесса
4. Qp = DHp -теплота изобарного процесса
5. DHp = DE + PDV -уравнение первого начала термодинамики для изобарных процессов
6. DH = ånDH0 298 обр. прод. реак. - ånDH0 298 обр. исх. веществ - первое следствие закона Гесса
7. DH = ånDH0 298 сгор. исход. в. - ånDH0 298 сгор. прод. реакции- второе следствие закона Гесса
8. Q = W -уравнение первого начала термодинамики для биосистем
9. DS = Q / T ¾¾ -энтропия как функция состояния системы
10. DS ³ 0 -уравнение второго начала термодинамики
11. S = ånS0 298 прод. р. - ånS0 298 исх. в. -расчет энтропии реакции
12. DG0 = DH0 - TDS0 -уравнения для расчета энергии Гиббса
13. DG0 = ånDG0 298 прод. р. - ånDG0 298 исх. в. расчет энергии Гиббса по реакции
14. DG0 = - 2,3RT lg Кс- уравнение изотермы химической реакции при стандартных условиях
15. 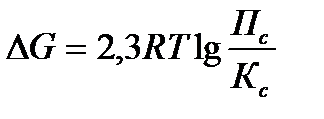 - уравнение изотермы химической реакции
- уравнение изотермы химической реакции
16. 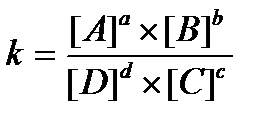 - константа химического равновесия, выраженная через равновесные концентрации вещества
- константа химического равновесия, выраженная через равновесные концентрации вещества
17. 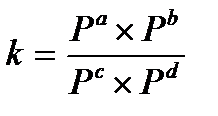 - константа химического равновесия, выраженная через равновесные парциальные давления вещества
- константа химического равновесия, выраженная через равновесные парциальные давления вещества
18. 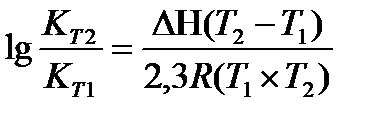 - уравнение изобары
- уравнение изобары
19. 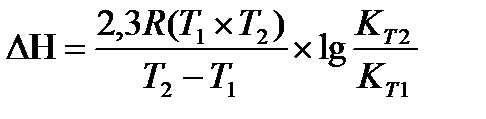 - расчет теплового эффекта по значениям констант
- расчет теплового эффекта по значениям констант
Таблица 1
Дата добавления: 2015-10-19; просмотров: 819;
