КОРОЗІЯ МЕТАЛІВ
Корозія металів - це самовільний процес їх руйнування внаслідок фізико-хімічної взаємодії з навколишнім середовищем. Корозійний процес відбувається на поверхні поділу метал-газ або метал - розчин, тобто є гетерогенним процесом.
Корозійні процеси класифікуються залежно від механізму реакції, умов перебігу процесів та характеру корозійних порушень.
В залежності від механізму реакції корозія може бути хімічною, та електрохімічною. Біохімічна корозія відбувається електрохімічним шляхом.
В залежності від умов перебігу процесів корозія буває газовою, атмосферною (руйнування металів у повітрі), грунтовою, електролітною та неелектролітною, під дією зовнішніх блукаючих струмів, структурною (при наявності домішок у металі), контактною (при контакті металів з різними потенціалами).
В залежності від характеру корозійних порушень корозію поділяють на суцільну рівномірну (1) або нерівномірну (2) та місцеву (3). У свою чергу місцева корозія може бути крапковою, плямистою, виразковою (4), міжкристалітною (5), селективною, з розтріскуванням (6) та ін.


 1 2 3
1 2 3
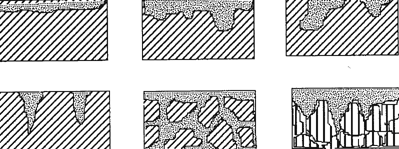
 |  |  |
4 5 6
Рис.6. Види корозійних порушень
1.Хімічна корозія
Хімічна корозія – це процес самовільного руйнування металів внаслідок хімічної взаємодії з зовнішнім середовищем, при якому окиснення та відновлення відбувається у одному акті. Хімічна корозія найчастіше спостерігається у сухих газах (О2, Сl2, Н2S та ін.) та неелектролітах (мастилах, мазуті, бензинах та інших видах палив, розплавленій сірці, рідкому НF та ін.).
Газова корозія є більш поширеною та відбувається при високих температурах у двигунах внутрішнього згоряння, турбінах, ракетних двигунах, у процесах термічної обробки металів тощо. Спочатку гази адсорбуються на поверхні металів, далі відбувається їх хімічна взаємодія та утворюються продукти корозії - оксидні або сольові плівки. Якщо плівка має захисні властивості, процес корозії гальмується. При умовах 2,5 < VМеО/VМе > 1 (де VМеО та VМе об’єми плівки і металу відповідно) плівки вважаються суцільними та міцними, мають добре зчеплення з металом, еластичні. Якщо це відношення більше 2,5, то внаслідок значних внутрішніх напружень плівка розтріскується, відшаровується від поверхні металу та втрачає захисну дію.
При високотемпературній взаємодії заліза, сталей і чавунів з газовими окисниками та продуктами згоряння палив мають місце різні процеси: окиснення заліза; окиснення та вилучення карбону (декарбонізація), виникнення водневої крихкості сталей; окиснення, декарбонізація та зростання чавунів.
При високих температурах залізо окиснюється й покривається шаром окалини, до складу якої входять магнетит Fe3O4 та гематит Fe2O3.

 4Fe + 3O2 t 2Fe2O3; 3Fe + 2O2 t Fe3O4.
4Fe + 3O2 t 2Fe2O3; 3Fe + 2O2 t Fe3O4.
Окиснення карбону і декарбонізація сталей відбувається за рівняннями:
 Fe 4C3 + 5O2 > 500oC 4FeO + 3CO2;
Fe 4C3 + 5O2 > 500oC 4FeO + 3CO2;
 Fe3C + O2 > 500oC 3Fe + CO2;
Fe3C + O2 > 500oC 3Fe + CO2;
 Fe3C + 2H2 > 500oC 3Fe + CH4,
Fe3C + 2H2 > 500oC 3Fe + CH4,
Сполуки Fe4C3 (карбід) і Fe3C (цементит) входять до складу сталей та чавунів. Внаслідок цих процесів поверхневий шар втрачає карбон, що впливає на експлуатаційні властивості деталей та споруд: зменшується поверхнева твердість і стійкість до механічних навантажень.
Воднева крихкість зумовлена утворенням молекулярного водню з атомарного, розчиненого в металі, яка відбувається при високих температурах. При цьому утворюється газ і пари води:
 FeO + H2 t Fe + H2O.
FeO + H2 t Fe + H2O.
Це явище сприяє виникненню великого тиску у об’ємах металу, появленню мікрошпар, які зменшують його міцність. Найменше піддаються водневій крихкості хромисті сталі та аустенітні хромонікелеві сталі.
Зростанням чавунів називають помітне збільшення розмірів чавунних деталей (до десятків відсотків) зі значним погіршенням міцності. Таке явище зумовлено окисненням цементиту по границях зерен з утворенням включень графіту (графітизацією чавуна) та відповідним збільшенням об’єму:
 Fe3C t 3Fe + C.
Fe3C t 3Fe + C.
Існують марки чавуна, які мало піддаються зросту. До них відноситься силаль (5...10 % Si), ніхросилаль (містить нікель і хром) та ін. Білий чавун менше піддається зросту, ніж сірий.
Корозія у неелектролітах досліджена для середовищ рідких палив. Самі вуглеводні при відсутності води не активні до металів і не руйнують їх. Корозійними компонентами палив є сполуки сірки - гідроген сульфід H2S, карбон сульфід CS2, тіофени та ін. Нафта різних копалин містить від 0,01 до 5 % сполук цього елемента. Наявність сполук сірки призводить до міжкристалітної корозії. Чим важче фракція перегонки нафти, тим більше там сірки, тому мазут викликає значно більшу корозію, ніж бензини та гаси. Підвищення температури та невеликі кількості води значно активізують процес.
На процес корозії дуже впливають продукти згоряння палива. Зола містить понад 30 елементів, серед яких Na, V, Fe, Ca, Si, Ni, Cu. Найбільшу агресивність мають сполуки натрію та ванадію, які утворюють комплексні сполуки з низькими температурами плавлення. Ці сполуки розчинюють захисті оксидні плівки та сприяють розвитку “ванадієвої корозії”. При згорянні важких палив з високими температурами кипіння утворюється також V2O5, який є каталізатором процесів окиснення.
Швидкість газової корозії залежить від зовнішніх і внутрішніх факторів. До зовнішніх відносять температуру, тиск, склад газового середовища та ін. Зі зростанням температури швидкість окиснення заліза і стали сильно зростає. На швидкість корозії також впливає склад газового середовища, особливо наявність кисню, сірки, води. Насичення повітря парою води прискорює корозію у 2...3 рази.
Внутрішніми називають фактори, пов’язані з природою та структурою металу, характером обробки його поверхні, наявності домішок у ньому. Так, збільшення концентрації карбону призводить до більш інтенсивного утворення СО2 і знижує корозію. Наявність сірки, фосфору, нікелю, мангану майже не впливає на процес корозії; наявність ванадію, молібдену, вольфраму сильно прискорює її внаслідок утворення легкоплавких летких оксидів, які руйнують захисну плівку основного металу; сильно зменшують газову корозію титан, мідь, кобальт, силіцій, алюміній та хром. Відомо, що грубо оброблена поверхня кородує значно інтенсивніше, ніж шліфована або полірована.
2. Електрохімічна корозія
Електрохімічна корозія металів зумовлена електрохімічною взаємодією їх з електропровідним зовнішнім середовищем. Вона спостерігається, коли поверхня металу вкрита електролітом. Суттєвими ознаками цього процесу є самовільне руйнування металів внаслідок їх термодинамічної нестійкості в даних умовах і наявність електричного струму в процесі корозії, який є напрямленим переміщенням електронів від одної ділянки на поверхні металів до другої.
Причинами утворення поверхні з різними потенціалами є неоднорідність твердої фази (сплави або мікровключення інших металів), в тому числі й внутрішні механічні навантаження, контакт двох різних металів; неоднорідність рідкої фази (неоднаковий склад електроліту, або неоднакова його концентрація у різних точках поверхні); неоднорідність фізичних умов (різні температури поверхні, змочування її, тощо).
Основна відміна електрохімічної корозії від хімічної складається в тому, що електрохімічна корозія є результатом роботи короткозамкнутих мікрогальванопар.
Цей процес складається з трьох етапів: анодне розчинення ділянки з більш негативним значенням потенціалу; перенесення електронів з анодних ділянок на катодні; катодні процеси, які найчастіше є взаємодією електронів з компонентами електроліту.
Анодний процес у загальному виді описується рівнянням
А: Ме + mН2О – nē «Ме n+. mН2О або скорочено А: Ме – nē «Ме n+.
У корозійних процесах окисник має специфічну назву - деполярізатор, а процес відновлення окисника - деполяризацією. У корозії деполяризаторами найчастіше бувають кисень повітря, вода та іони водню, які відновлюються на катодних ділянках. Наприклад:
К: 2H+ + 2ē ® H2 (воднева деполяризація);
К: O2 + 2H2O + 2ē ® 4OH– (киснева деполяризація, нейтральне середовище).
К: O2 + 2Н+ + 2ē ® Н2О (киснева деполяризація, кисле середовище).
К: 2Н2О + 2ē ® Н2 + 2ОН–.
Киснева деполяризація зустрічається найчастіше у природі й відбувається при атмосферній корозії (у вологому повітрі), корозії в різних водах (морській, річній, водопровідній) та в грунтах.
Воднева деполяризація часто спостерігається в промислових процесах у кислому середовищі, при корозії в атмосфері промислових районів, насиченій СО2, SO2, H2S та ін. Іноді вона трапляється в природі при грозових розрядах і вулканічній діяльності.
Схема гальванічного елемента при корозії заліза у вологому повітрі, в якому є кисень та пара води буде така:
(–) Fe|Fe2+,O2, H2O, OH–|Fe (+).
Між вертикальними рисками вказуються компоненти середовища, які беруть участь у корозійному процесі та утворюються внаслідок його.
Крім електрохімічних реакцій, при яких утворюються первинні продукти корозії (Меn+, Н2, ОН–), корозія супроводжується протіканням вторинних хімічних процесів, наприклад, взаємодії іонів металу с гідроксид-іонами або аніонами кислотних залишків з утворенням вторинних продуктів корозії - гідроксидів, оксидів, солей. Плівки цих сполук можуть мати захисні властивості і впливають на подальший процес корозії.
Від сказаного вище випливає, що процеси при електрохімічній корозії аналогічні процесам у гальванічному елементі. Основна їх різниця складається у тому, що у корозійному гальванічному елементі відсутнє зовнішнє коло: електрони в процесі корозії не виходять за межі метала. Хімічна енергія реакції не передається у вигляді роботи, а перетворюється на теплову.
Дата добавления: 2015-09-18; просмотров: 1526;
