Термодинаміка та кінетика електрохімічної корозії
Швидкість корозії, як і будь-якого хімічного процесу, вимірюється зміною концентрації речовин протягом взаємодії. Корозія є гетерогенним процесом, тому її вимірюють зміною маси перетвореної речовини на одиниці поверхні (1см2, 1дм2). За законами Фарадея маса перетвореної речовини визначається за формулою m = МEIt/F. Враховуючи зміну маси на одиницю поверхні ділянок маємо:
m = МEIt/FS, або m = МEiкорt/F,
де ікор – густина корозійного струму на катодних і анодних ділянках.
З цього рівняння можна зробити висновок, що швидкість корозії, перш за все, визначається природою металу та густиною корозійного струму. Наприклад, за рік, при однакової силі струму, корозійні втрати алюмінію складають 2,9 кг, а цинку – 10,7 кг.
Інтенсивність процесів корозії залежіть також від природи електроліту та концентрації розчинених в ньому речовин. Так наявність іонів в ньому прискорюють корозію, оскільки збільшується електропровідність розчину. Крім того, деякі іони впливають на кінетику процесів корозії. Катіони активних металів (Na+, K+, Ca2+, Mg2+, Ba2+) не оказують специфічного впливу на цей процес, а катіони малоактивних металів (Ag+, Au3+, Cu2+), які є окисниками, різко збільшують корозію заліза та алюмінію. Наприклад, при наявності іонів Cu2+ відбувається реакція Fe0 + Cu2+ ® Fe2+ + Cu0, утворюється корозійний гальванічний елемент (-)Fe|Fe2+, H2O, O2, NaCl, OH– |Cu (+) , який спричинює подальшу корозію заліза:
А: Fe0 - 2ē ® Fe2+;
К: (Сu) O2 + 2H2O + 4ē ® 4OH–.
Особливо активними активаторами корозії є аніони галогенів Cl–, F–, Br– та ін. Вони руйнують захисні оксидні плівки металів і облегшують доступ компонентів електроліту до поверхні металу. Наприклад, при корозії алюмінію у присутності хлорид-іонів захисна плівка оксиду алюмінію руйнується і він активно кородує:
A: Al0 - 3ē ® Al3+
 К: (Al2O3) O2 + 2H2O + 4ē ® 4OH–
К: (Al2O3) O2 + 2H2O + 4ē ® 4OH–
4 Al + 3O2 + 6H2O ® 4Al (OH)3.
Корозія, як самовільний процес відбувається, якщо зміна енергії Гіббса DG < О. Ця величина зв’язана з ЕРС гальванічного елемента співвідношенням DG = –nЕF, тому можливість процесу корозії можна встановити визначенням знаку Е (ЕРС) - якщо електрорушійна сила корозійного елемента має позитивне значення, то корозія можлива. ЕРС корозійного елемента розраховується за формулою
Е = jкат.пр. - jан.
У випадку утворення корозійних гальванічних елементів потенціал катода не дорівнює потенціалу катодної реакції. Знання потенціалів катода та анода необхідно тільки для визначення катодних і анодних ділянок, а при розрахунку значення ЕРС треба брати до уваги потенціал катодного процесу (деполяризації).
Потенціал реакції кисневої деполяризації залежить від умов процесу та перенапруги відновлення кисню на поверхні катоду та коливається у межах 1,23...0,4 В. У розрахунках найчастіше приймають значення j(O2|OH–) = = +0,82 B. Потенціал реакції водневої деполяризації змінюється у межах -0,81...0 В. У розрахунках найчастіше приймають значення j(2Н+|H2) = = -0,41 B. Всі метали, алгебраїчна величина потенціалу яких менше цих значень, можуть кородувати з водневою або кисневою деполяризацією.
Корозія ніколи не відбувається за стандартними умовами, тому орієнтуватися на стандартні значення електродних потенціалів металів можна лише приблизно. Корозію характеризує так званий стаціонарний потенціал металу в даному середовищі. При досягненні стану рівноваги DG = O, ікат = іанод. Цьому процесу відповідає самовільне розчинення металу при стійкому певному потенціалі. Стаціонарним (рівноважним) називається потенціал (jстац), при якому швидкості катодного та анодного процесів при корозії металу за певних умов дорівнюють одна одній. Його неможливо розрахувати за рівнянням Нернста і визначається він тільки дослідним шляхом.
У процесах корозії, як і в гальванічних елементах, на значення стаціонарного потенціалу впливають катодна та анодна поляризації. Вони виникають тому, що переміщення електронів відбувається швидше, ніж електродні реакції. Анодна поляризація зміщує потенціал анодних ділянок до більш позитивних значень і зумовлена уповільненням реакції окиснення та утворенням оксидних плівок. Катодна поляризація зміщує потенціал у бік більш негативних значень і виникає внаслідок зменшення концентрації окисника в електроліті, зменшенням швидкості відновлення, утворення на поверхні металів газів тощо. Особливо велике значення для цих процесів мають перенапруги процесів відновлення кисню та водню на катодах.
Для дослідження процесів поляризації вивчають поляризаційні криві, що виражають залежність потенціалів катодних і анодних ділянок від швидкості корозії (катодної і анодної густини струму). Явище поляризації є корисним у процесах корозії, тому що потенціали катодних і анодних ділянок зближуються, ЕРС корозійного гальванічного елемента зменшується і корозія уповільнюється.
Поляризація зумовлює явище пасивації металів, коли потенціали катодної та анодної ділянки зближуються настільки, що становляться практично рівними. Під терміном “пасивність” розуміють такий стан металу, коли він практично не піддається корозії. В цьому стані практично можливий процес анодного розчинення металів майже повністю гальмується. Багато металів, що мають велике практичне значення (алюміній, хром, нержавіючі сталі, нікель) характеризуються пасивним станом у атмосферних умовах. Залізо пасивується концентрованими сульфатною та нітратною кислотами (ці кислоти перевозять у залізних цистернах), розчинами нітратів, хроматів.
Пасивація зумовлена утворенням захисних плівок на поверхні металів – оксидних або сольових. Ці плівки ізолюють поверхню металу від корозійного середовища, перешкоджають дифузії реагентів, змінюють потенціал поверхні. Так само діють і легувальні домішки. Так, при збільшенні вмісту хрому в сталях близько 12 %, потенціал сталі становить +0,2 В, тобто хром переводить сталь у пасивний стан.
Для вимірювання реального стаціонарного потенціалу використовують гальванічний елемент, складений з електрода порівняння (наприклад, хлорсрібного) та електрода з дослідженого метала, зануреного у електроліт того ж складу, в якому відбувається процес корозії. Потім вимірюється ЕРС гальванічного елементу й по різниці потенціалів визначається невідомий потенціал електродної реакції.
Наприклад, для визначення стаціонарного потенціалу міді в морській воді треба скласти гальванічний елемент з мідного електрода та електрода порівняння (хлорсрібного), занурених у розчин морської води (або його імітат) та виміряти його ЕРС. Мідь в даному випадку є анодом, jхл.ср = 0,203 В. Виміряна ЕРС дорівнює0,1 В.
Е = jкат - jан, звідки jан. = jкат – Е = 0,203 -0,1 = 0,103 В.
Значення стаціонарного потенціалу менше, ніж стандартного (+0,34 В), тому можна зробити висновок, що у морський воді потенціал міді зменшується. У таблиці наведені стаціонарні потенціали деяких металів і сплавів у морській воді.
Таблиця. Стаціонарні потенціали металів і сплавів у морській воді
| Метал, сплав | j0, В | jстац, В | Метал, сплав | j0,В | jстац, В |
| Cu | +0,34 | –0,08 | Mg | –2,37 | –1,45 |
| Sn | –0,14 | –0,25 | Zn | –0,76 | –0,80 |
| Fe | –0,44 | –0,50 | Сталь 09Г2 | – | –0,40 |
| Ti | –1,63 | +0,10 | Сталь 10ХСНД | – | –0,40 |
| Al | –1,66 | –0,54 | Сталь 9Х18Н1Т | – | ±0,10 |
Дані цієї таблиці можуть суттєво змінюватися в залежності від солоності морської води, вмісту кисню, температури тощо. З неї також видно, що тільки титан у морській воді набуває позитивного потенціалу. Тому для нього характерна надзвичайна корозійна стійкість у цьому середовищі. Раніше й мідь з успіхом використовувалася як корпусний метал, тому що її потенціал наближується до 0. Корпусні сталі 09Г2 та 10ХСНД не стійкі у морській воді, а сталь 9Х18Н10Т може бути стійкою у залежності від складу води.
Розглянемо декілька прикладів корозійних гальванічних елементів.
Приклад1. Записати процеси та розрахувати ЕРС і DG0 корозійного елементу, утвореного при корозії сталі у морській воді.
Розв’язання:
Особливістю морської води як корозійного середовища є висока концентрація солей (від 3 до 40 г/л), яка знижує опір електроліту; великий вміст хлорид-іонів, які є найсильнішими активаторами корозії; енергійне перемішування з одночасною аерацією; великий вміст кисню (до 10 мг/л); присутність біологічних факторів, які сприяють біокорозії. У морській воді відбувається електрохімічна корозія заліза та його сплавів з кисневою деполяризацією і утворюється корозійний гальванічний елемент за схемою:
(-) Fe|Fe2+, H2O, O2, NaCl, OH–|Fe (+)
або скорочено (-) Fe|H2O, O2, NaCl|Fe (+).
Електродні процеси будуть наступними:
А: Fe0 - 2ē ® Fe2+; j м.в.(Fe2+|Fe0) = -0,50 B.
 К: (Fe) O2 + 2H2O + 4ē ® 4OH–; j(O2|OН–) = +0,82 B.
К: (Fe) O2 + 2H2O + 4ē ® 4OH–; j(O2|OН–) = +0,82 B.
2Fe + O2 + 2H2O ® 2Fe(OH)2.
Після утворення гідроксиду заліза у системі йдуть вторинні процеси:
2Fe(OH)2 + O2 + 2H2O ® 2Fe(OH)3;
Fe(OH)3 ® FeOOH + H2O.
Вважається, що формула FeOOH відповідає сполуці, яка входить до складу іржи. ЕРС та DG0 елементу розраховуються за формулами:
Е = jкат.пр - jан = j(O2|OH–) - jм.в(Fe2+| Fe0) = 0,82 - (-0,50) = 1,32 В.
DG0 = -nEF = - 2.1,32. 96500 = -254760 Дж.
Відповідь: Е = 1,32 В, DG0 = -254760 Дж.
Приклад2. Записати процеси та розрахувати ЕРС і DG0 корозійного елементу, утвореного при корозії заліза у вологому повітрі.
Розв’язання: О2
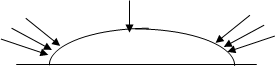 О2 О2
О2 О2
К А К
Розглянемо цей процес. На поверхні металу конденсуються краплі вологи, причому в центрі краплі товщина рідкого шару більше, ніж на краях. Кількість кисню у середині краплі менше, тому в центрі утворюється анодна, а по краях краплі - катодна ділянки мікрогальванічного корозійного елемента. Схема та електродні процеси будуть наступними:
(-) Fe|Fe2+, H2O, O2, OH–|Fе (+).
А: Fe0 - 2ē ® Fe2+ ; j в.п(Fe2+| Fe0) = -0,48 B,
К: (Fe) O2 + 2H2O + 4ē ® 4OH–; j(O2|OH–) = +0,82 B.
Наявність іонів заліза перевіряють реакцією з червоною кров’яною сіллю:
Fe2+ + K3[Fe(CN)6] ® KFe[Fe(CN)6] ¯+ K2+.
синє забарвлення
Наявність іонів гідроксиду перевіряють реакцією з фенолфталеїном (у лужному середовищі фенолфталеїн має малинове забарвлення).
Сумарна реакція має вигляд:
2Fe + O2 + 2H2O ® 2Fe(OH)2.
Далі відбуваються такі ж процеси, як і при корозії сталі у морській воді.
Е = jкат.пр. - jан. = j(O2|OH–) - jв.п(Fe2+| Fe0) = 0,82 - (-0,48) = 1,30 В.
DG0 = -nEF = -2.1,30 . 96500 = -250900 Дж.
Відповідь: Е = 1,30 В, DG0 = -250900 Дж.
Приклад3. Записати процеси у корозійному елементі, утвореному приконтакті двох форм структури сталі.
Розв’язання:
Найчастіше сталь має дві структурні форми, які відрізняються вмістом карбону і структурою кристалічної решітки. Це цементит і перліт, причому jстац(перл) < jстац(цем).
Утворюється наступний корозійний гальванічний елемент
(-) перліт | морська вода, О2 | цементит (+).
Процеси на анодних і катодних ділянках будуть такі:
А: Fe0 - 2e ®Fe2+
К: (Fe) O2 + 2H2O + 4e ® 4OH–.
Вторинні процеси ті ж самі, що й у попередніх прикладах.
Приклад4. Записати процеси та розрахувати ЕРС і DG0 у корозійному елементі, утвореному при корозії латуні в морській воді.
Розв’язання:
Латунь - це сплав цинку з міддю. В таблиці знайдемо стаціонарні потенціали цинку та міді в морській воді.
jм.в(Zn2+|Zn0) = -0,8 B, jм.в(Cu2+|Cu0) = -0,08 B. Виходячи з цих даних встановлюємо, що цинк у даній парі буде анодом, а мідь - катодом. Схема утвореного корозійного елементу буде наступною:
(-) Zn|H2O, NaCl, O2 |Cu (+);
A: Zn0 - 2ē ® Zn2+
 K: (Cu) O2 + 2H2O + 4ē ® 4OH–
K: (Cu) O2 + 2H2O + 4ē ® 4OH–
2Zn + O2 + 2H2О ® 2Zn(OH)2; Zn(OH)2 ®ZnO + Н2О.
У цьому випадку цинк є анодом, він розчиняється з утворенням малорозчинних гідроксиду та оксиду, при цьому швидкість процесу корозії зменшується. Корозію спричинює неоднорідність металевої фази.
Е = jкат.пр. - jан. = j(O2|OH–) - j м.в(Zn2+|Zn0) = 0,82 - (-0,80) = 1,62 В.
DG0 = -nEF = -2.1,62 . 96500 = -312660 Дж.
Відповідь: Е = 1,62 В, DG0 = -312660 Дж.
Приклад5. Записати процеси у корозійному елементі, утвореному при корозії алюмінію у морській воді.
Розв’язання:
При порушенні плівки Al2O3 на деталях з алюмінію виникає гальванічний елемент (-) Al|H2O, O2, NaCl|Al2O3 (+), у якому відбуваються процеси:
A: Al0 - 3ē ® Al3+
 K:(Al2O3) O2 + 2H2O + 4ē ® 4OH–
K:(Al2O3) O2 + 2H2O + 4ē ® 4OH–
4 Al + 3O2 + 6H2O ® 4Al (OH)3.
Порушення оксидних плівок може відбуватися як механічним шляхом, так і при наявності у воді іонів галогенів, які прискорюють процес корозії.
Біохімічна корозія
У процесах біохімічної корозії приймають участь агресивні продукти життєдіяльності різних мікроорганізмів (кислоти, альдегіди, кетони, ферменти та ін.). У грунтах, воді та нафті у корозійних процесах приймають участь бактерії, деякі з них активно руйнують залізо та алюміній. Існує аеробна (на повітрі) і анаеробна (без повітря) корозія та грибкова корозія. Біологічні фактори сприяють обростанню суден, що приводить до зменшення їх швидкості. До підводної частини прилипають різні молюски (наприклад, мідії), водорості. Кількість біомаси залежить від стану водного басейна. Так, у Каспійському морі за один рік наростає 30 кг/м2, а у Балтійському всього 0,3 кг/м2 біомаси. Збільшення товщини наростів до 20 см призводить до підвищення витрат палива для досягнення тих же швидкостей на 40 %.
Питання та задачі
1. Дати визначення терміну “корозія металів”.
2. Охарактеризувати типи корозійних процесів в залежності від механізму процесу.
3. Охарактеризувати типи корозійних процесів в залежності від корозійних порушень і умов процесу.
4. Що таке “хімічна корозія”, “біохімічна корозія”? Коли вони відбуваються?
5. Які корозійні процеси відбуваються при газовій корозії заліза та його сплавів? Від яких умов вона залежіть?
6. Пояснити корозію заліза у неелектролітах.
7. Дати визначення поняттю “електрохімічна корозія”. Чим вона відрізняється від хімічної корозії?
8. Пояснити анодні та катодні процеси при електрохімічній корозії.
9. Що таке “деполяризатор² і “деполяризація”? Які деполяризаційні процеси Ви знаєте, де вони зустрічаються?
10. Чому чисте залізо не кородує, а залізо з домішками кородує досить швидко? Скласти схему корозії заліза у вологому повітрі.
11. Пояснити термодинамічні умови перебігу корозійних процесів.
12. Що таке “швидкість корозії”, в чому вона вимірюється?
13. Дати визначення поняттю “стаціонарний потенціал”. Як він визначається й від чого залежіть?
14. Пояснити особливості процеси корозії заліза та його сплавів у морській воді.
15. До чого призводить нерівномірне нагрівання трубопроводів з гарячою водою у морських умовах. Яка частина трубопроводу - холодна чи гаряча буде інтенсивно кородувати?
16. Пояснити особливості процеси корозії заліза та його сплавів у вологому повітрі та повітрі промислових районів.
17. Корозія кольорових металів і їх сплавів у морській воді.
18. Активатори корозії.
19. Пояснити корозію бронзи (сплаву міді та олова) у морській воді. Скласти схему корозійного гальванічного елементу.
20. Залізо знаходиться в контакті з міддю. Який металів буде окиснюватися при корозії, якщо ця пара буде знаходитись у вологому повітрі? Навести схему корозійного елемента, що утворюється. Написати схеми процесів на електродах.: jв.п(Fe2+|Fe0) = -0,48 B, jв.п(Cu2+|Cu0) = +0,25 B, j(O2|OH–) = +0,82 B.
21. На основі розрахунку ЕРС показати, які з пар металів при роботі в морській воді будуть найбільш корозійно небезпечними: а) Fe – Cu; б) Fe – Zn; в) Zn – Cu. Потенціали металів в цих умовах відповідно дорівнюють: jм.в(Fe2+|Fe0) = -0,50 B, jм.в(Zn2+|Zn0) = -0,8 B, jм.в(Cu2+|Cu0) = +0,05 B, j(O2|OH–) = +0,82 B.
22. Нікель знаходиться у контакті з міддю у вологому повітрі. Записати схему утвореного корозійного гальванічного елемента, катодну та анодну реакції та визначити ЕРС, якщо стаціонарні потенціали нікелю та міді за цих умов відповідно дорівнюють –0,34 В та +0,25 В, j(O2|OH–) = +0,82 B.
23. Який з металів Fe або Cu буде руйнуватися у атмосфері вологого повітря насиченого карбон (IV) оксидом? Записати схему корозійного гальванічного елемента. Які процеси при цьому відбуваються? jв.п(Fe2+|Fe0) = -0,48 B,
jв.п(Cu2+|Cu0) = +0,25 B, j(O2|OH–) = +0,82 B, j(2Н+|Н20) = –0,41 В.
Дата добавления: 2015-09-18; просмотров: 1340;
