ЗАХИСТ ВІД КОРОЗІЇ
Корозія завдає великої шкоди народному господарству. Вона знищує близько 10 % виплавленого за кожний рік метала, що становить десятки мільйонів тон. Ще більших збитків зазнає народне господарство від корозії готових виробів. В нашій крайні щорічні збитки оцінюються у 3…4 млрд. гривень. Це тільки так звані прямі втрати. Великі втрати завдає забруднення довкілля, підрахувати їх навіть неможливо. Тому боротьба з корозією є одним з найважливіших завдань науки і техніки, особливо у індустріально розвинутих країнах .
Для того, щоб запобігти корозії або усунути корозію металів та сплавів найчастіше використовують такі методи захисту: ізоляцію металів від навколишнього середовища; електрохімічні методи захисту металів; використання інгібіторів корозії; легування сталей; раціональне проектування конструкцій з урахуванням всіх корозійних факторів; використання полімерних матеріалів замість металевих.
Найчастіше використовують одночасно декілька методів, тому що тільки один з методів не дає необхідного захисного ефекту.
Основними способами захисту від газової корозії є використання жароміцних та жаростійких сплавів, використання захисних покриттів, використання захисних газових середовищ. При експлуатації при високих температурах необхідно враховувати не тільки опірність металу окисненню, але і його механічні властивості. Саме міцність металу, найчастіше, є вирішальною умовою його вибору.
Жароміцними називаються матеріали, що зберігають свої механічні властивості при високих температурах. Такими металами є вольфрам, молібден, осмій та ін. Жаростійкими називають матеріали, які проявляють підвищену стійкість до окиснення в умовах високих температур. Такими матеріалами є сплави на основі заліза або нікелю та леговані хромом або алюмінієм.
Існують також матеріали, які відрізняються особливою стійкістю в окиснювальних середовищах при збереженні міцності. Це сплави на основі нікелю та кобальту, металокерамічні матеріали (кермети). Кермети одержують методом порошкової металургії. До їх складу входять оксиди, карбіди, нітриди, бориди, а метали виступають в’яжучою речовиною. Такі матеріали застосовуються для виготовлення турбінних лопаток, різальних частин металообробного інструменту, бурових свердел, сопел та ін.
Захисні атмосфери використовуються переважно в металургійних галузях, та при термообробці і зварюванні металів. Допустима концентрація агресивних газів (О2, Н2, СО2, СО та ін.) залежить від температури, виду металу, компонентів сплаву та визначається за допомогою констант рівноваги реакцій окиснення, декарбонізації та ін. Серед захисних атмосфер використовуються: глибокий вакуум, інертні гази, пічні гази, атмосфера технічного азоту.
Для ізоляції металів від дії агресивного довкілля використовують: нанесення лакофарбових покрить та (або) металевих покрить; пасивацію поверхні металу оксидними та сольовими плівками.
Нанесення лакофарбових покрить - це досить надійний захист від корозії в певних умовах. Для цього використовують перхлорвінілові, пентафталеві, кремнійорганічні фарби та емалі, епоксидні смоли. Ці покриття мають добру адгезію з основним металом, певні фізичні властивості (незначні внутрішні напруги, мікротвердість, щільність), гарний зовнішній вигляд і невелику вартість. Їх головний недолік – невеликий строк дії. Наприклад, для умов морського клімату він дорівнює 1,5 ¸ 2 роки.
Найчастіше наносять кілька шарів покриття. Той шар, який наноситься безпосередньо на поверхню металу та забезпечує міцність зчеплення називається грунтом (його товщина дорівнює приблизно 20 мкм). В суднобудуванні використовують акрилові, гліфталеві, перхлорвінілові та інші грунти.
Металічні покриття. Основним методом захисту від корозії є нанесення металічних покрить. За своєю природою вони можуть бути катодними (їх потенціал вище потенціалу основного металу) і анодними (їх потенціал нижче, ніж потенціалу основного металу). Захисне покриття повинне бути щільним і не мати пор.
Метали можна наносити кількома способами. Хімічне нанесення можна використовувати, коли менш активний метал легко відновлюється на більш активному металі. Наприклад, часто використовують хімічне нікелювання заліза з розчинів певного складу. Можна наносити розплавлений метал на основний, наприклад, гаряче цинкування заліза. Але це досить дорогий процес і його вживають тоді, коли інші процеси застосувати неможливо, наприклад, цинкування труб зсередини. Практичне використання мають також процеси гарячого лудіння та свинцювання.
Найбільше розповсюдження мають покриття, нанесені гальванічним шляхом. Їх перевага - можливість отримання покрить певної товщини, невелика вартість процесу, економне витрачання кольорових металів, висока якість покриття. Найбільш поширені цинкування, кадмування, нікелювання, мідніння, хромування, свинцювання, покриття сплавами.
Розглянемо декілька прикладів.
Цинкування заліза. Аноди – цинкові, катоди – залізні деталі, електроліт - розчин сульфат цинку (200¸250 г/л), сульфат натрію, сульфат алюмінію, декстрин. рН 3,5...4,5, температура – 15...25 °С, густина струму 1...2 А/дм2.
Можливе цинкування з лужних електролітів до складу яких входять оксид цинку та гідроксид натрію.
Нікелювання заліза. Аноди - нікелеві, катоди - залізні деталі, електроліт - розчин сульфату нікелю 250...350 г/л, сульфатної та борної кислоти , рН = 2,5... 4,5, температура 45¸60 °С, густина струму 2,5...10 А/дм2. Для блискучого нікелювання у розчин додають блискоутворюючі домішки - лаурілсульфат натрію, 1,4 - бутилдіол та ін.
Хромування заліза. Аноди – свинцеві, катоди – залізні деталі, електроліт – гарячий розчин хромового ангідриду CrO3 у воді (утворюється хромова кислота Н2СrO4 ) та сульфатної кислоти. Свинцеві аноди використовуються тому, що хромові інтенсивно розчинюються у електроліті з утворенням іонів тривалентного хрому, який заважає процесу. У розчині, який містить сульфат-іони на їх поверхні утворюється нерозчинний осад PbSO4 і вони є інертними у цьому процесі. Велика кількість електрики витрачається на побічні процеси розкладу води та інші, тому вихід за струмом при хромуванні не перевищує 10...40 %. Електроліт постійно треба коректувати, тому що внаслідок осадження хрому він поступово збіднюється. Густина струму 30...100 А/дм2. Незважаючи на всі ці складні умови процесу, хромові покриття широко використовуються, тому що мають певні переваги перед другими покриттями. Вони декоративні, беспористі, можуть бути блискучими, матовими або чорними, мають велику твердість, корозійну та хімічну стійкість, жаростійкість.
Металеві покриття захищають метал тільки тоді, коли вони не мають порушень. При порушенні покриття більш активний метал розчинюється.
Розглянемо два приклади.
Приклад 1.Описати процеси, які виникають при порушенні цинкового покриття на залізі у вологому повітрі та розрахувати ЕРС утвореного корозійного гальванічного елемента.
Розв’язання:
Залізо вкрито цинком. З таблиць візьмемо стаціонарні значення потенціалів цих металів і потенціал реакції деполяризації: jв.п(Fe2+|Fe0) = -0,48 B, jв.п(Zn2+|Zn0) = -0,78 B, j(O2|OH–) = + 0,82 B.
Цинк – анодне покриття, тому що його потенціал більш негативний. При порушенні покриття цинк, як більш активний метал, починає розчинятися, утворюючи потім нерозчинну плівку з гідроксиду та оксиду цинку. Основний метал не кородує до тих пір, доки весь цинк не розчиниться.
А: Zn – 2ē ® Zn2+
 К: (Fe) O2 + 2Н2О + 4ē ® 4OH–
К: (Fe) O2 + 2Н2О + 4ē ® 4OH–
2Zn + O2 +2H2O ® 2 Zn (OH)2 .
Zn (OH)2 ® ZnO + H2O.
Е = jкат.пр - jан = j(O2|OH–) - jв.п(Zn2+|Zn0) = 0,82 - (-0,78) = 1,6 В.
Відповідь: Е = 1,6 В.
Приклад 2.Описати процеси, які виникають при порушенні нікелевого покриття на залізі у вологому повітрі. та розрахувати ЕРС утвореного корозійного гальванічного елемента.
Розв¢язання:
Залізо вкрито нікелем. З таблиць візьмемо стаціонарні значення потенціалів цих металів і потенціал реакції деполяризації: jв.п(Fe2+| Fe0) = -0,48 B, jв.п(Ni2+|Ni0) = -0,30 B, j(O2|OH–) = +0,82 B. Нікель - катодне покриття, тому що його потенціал більш позитивний. При порушенні нікелевого покриття на залізі виникає гальванічний елемент (-) Fe|H2O, O2|Ni (+) у якому відбуваються процеси:
А: Fe0 - 2ē ® Fe2+
 К: (Ni) O2 + 2H2O + 4ē ® 4OH–
К: (Ni) O2 + 2H2O + 4ē ® 4OH–
2 Fe + O2 + 2H2O ®2Fe (OH)2.
2Fe(OH)2 + O2 + 2H2O ® 2Fe(OH)3;
Fe(OH)3 ® FeOOH + H2O .
Е = jкат.пр - jан = j(O2|OH–) - jв.п (Fe2+|Fe0) = 0,82 - (-0,50) = 1,32 В.
При порушенні нікелеве покриття не захищає залізо від корозії й під плівкою нікелю утворюється іржа.
Відповідь: Е = 1,32 В
Утворення захисних плівок. Стійки проти корозії захисні оксидні та сольові плівки можна добути обробкою металу різними хімічними реагентами. Цей метод захисту називається пасивацією.
Наприклад, залізо пасивують оксидні плівки. У процесі оксидації на залізо та його сплави наносять хімічним шляхом штучну оксидну плівку Fe3O4 з гарячих лужних розчинів. Вона пориста і для підвищення її антикорозійних властивостей поверхню просочують олією. Плівка має благородний чорний колір, тому процес інакше зветься воронінням та використовується для покриття деталей, які мають точні розміри, рушниць, пістолетів, вимірювальної техніки.
Для підвищення антикорозійних властивостей алюмінію його вкривають штучною оксидною плівкою, яку добувають методом анодного окиснювання у розчинах сульфатної кислоти. Плівка має високу твердість і декоративний вигляд. Часто її використовують як грунт під лакофарбове покриття.
Фосфатування – це хімічний процес утворення нерозчинних фосфатних плівок, які мають високі антикорозійні властивості. Для цього використовують суміш фосфатів заліза та мангану у розчині фосфатної кислоти (препарат Мажеф). Подібний склад має й так званий перетворювач іржи, який наноситься тонким шаром на іржаву поверхню і утворює на неї нерозчинну плівку фосфатів заліза Фосфатна плівка використовується як грунт під фарбування. Фосфатування з подальшим фарбуванням вважається найбільш економічним високоякісним захисним покриттям і широко використовується у промисловості.
Електрохімічний захист
Протекторний захист. Протектор – більш активний метал, який приєднується до деталі (корпусу суден) з основного металу. Протектор має невелику швидкість власної корозії, не покривається продуктами корозії. Найчастіше для захисту залізних споруд використовується цинк, магній, сплав алюмінію з магнієм. Радіус дії протектора - біля 50 м. Для захисту 1000 м2 поверхні корпусу суден необхідно поставити 1120 кг цинкових протекторів, або 400 кг алюмінієвих. По мірі розчинення протектори змінюють.
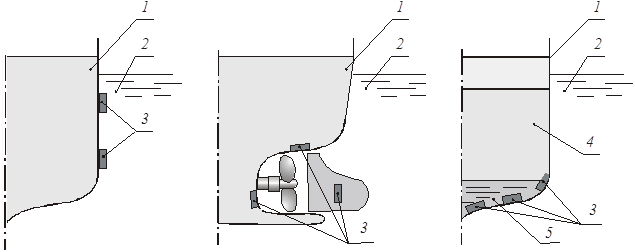
Рис. 7. Протекторний захист корпусу суден: 1– корпус; 2 – водойом; 3 – протектори; 4 – нафта; 5 – підтоварна вода
На корпусах судів протектори змінюють раз у рік.
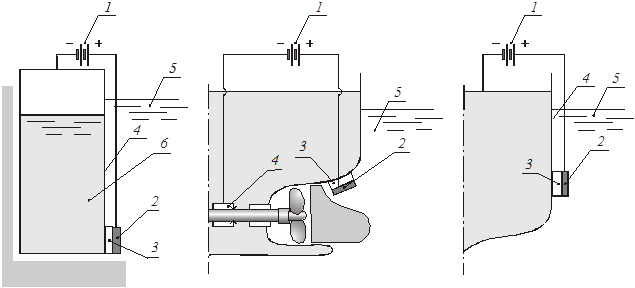 Катодний захист (електрозахист). У цьому способу деталь, яку треба захистити від корозії приєднують до негативного полюсу зовнішнього джерела струму, тобто у електрохімічному колі вона становиться катодом. Анодами служать металевий лом, балки, графіт, які поступово кородують. Вони екрановані від деталі, яка захищається (корпус суден, бурові вежі, стальні опори, нафтопроводи) гумовими екранами. Радіус дії катодного захисту приблизно 2000 метрів, густина струму на катоді 10–6 А/дм2. Вважається, що це більш надійний захист, ніж протекторний.
Катодний захист (електрозахист). У цьому способу деталь, яку треба захистити від корозії приєднують до негативного полюсу зовнішнього джерела струму, тобто у електрохімічному колі вона становиться катодом. Анодами служать металевий лом, балки, графіт, які поступово кородують. Вони екрановані від деталі, яка захищається (корпус суден, бурові вежі, стальні опори, нафтопроводи) гумовими екранами. Радіус дії катодного захисту приблизно 2000 метрів, густина струму на катоді 10–6 А/дм2. Вважається, що це більш надійний захист, ніж протекторний.
Рис.8. Катодний захист. 1 – джерело струму; 2 – анод; 3 – екран; 4 – деталь, яка захищається; 5 – водойом; 6 – нафта
Ці види захисту обов’язково використовуються разом з лакофарбовими покриттями.
Захист від корозії інгібіторами
Інгібітори корозії – це речовини, які зменшують швидкість процесу корозії. Вони вводяться безпосередньо у корозійне середовище або наносяться на поверхню метала. Перевага цього метода складається в тому, що він дозволяє обходитись без розбирання вузлів й деталей і в той же час ефективно захищає їх під час транспортування та зберігання. На даний час відомо понад 3000 інгібіторів.
Широке використання дістали інгібітори атмосферної корозії. Ці інгібітори розділяються на дві групи. Леткі інгібітори - це речовини, які здатні своєю парою захищати метали. Вони ефективно діють на деякій відстані від деталей. До них відносяться карбонат моноетаноламіну та нітрит дициклогексиламіну (НДА). Остання сполука гальмує корозію сталі на 5...10 років. Вони засипаються у вигляді порошку усередину упаковки. Нелеткі інгібітори діють тільки при безпосередньому контакті з металом. До них відносяться, наприклад, натрій нітрит і натрій бензоат. Вважають, що їх дія заснована на утворення адсорбційних шарів на поверхні металів.
Інгібітори кислотної корозії використовують для захисту металів у кислому середовищі. Більшість металів і, особливо, сплави заліза перед покриттям піддають травленню для очищення від іржи та зняття оксидної плівки. У цих процесах часто травиться й основний метал. Для запобігання цього у розчини кислот додають речовини, що утворюють там колоїдні частинки - желатину, декстрин, відходи цукрового виробництва, а також спеціалізовані присадки. За їх допомогою на поверхні металів одержують адсорбційні шари, які запобігають подальшому процесу травлення.
Велике значення мають інгібітори корозії в воді. На практиці часто металеві вироби постійно контактують з водою в замкнутих циклах. Воду використовують для охолодження двигунів, як баласт на річкових і морських судах, її заливають в опалювальні системи. Водопровідна і, особливо, морська вода сприяють сильній корозії металів, тому в цих процесах широко використовують інгібітори. Для захисту сталей широко використовуються уротропін, суміш амоній карбонату та натрій нітриту. Сплави міді добре захищає суміш з натрій бензоату та натрій нітриту.
Мастила та олії захищають від корозії тимчасово. Для підвищення їх дії до них теж часто додають інгібітори, наприклад, для сталей – карбонат моноетаноламіну. Більшість цих речовин розчинна у воді та при проникненні вологи під шар змазки утворює захисний водний шар з розчиненим інгібітором. Для кращого диспергування цих речовин у мастила додають також емульгатори ОП-7 і ОП-10.
Легування сталей. Легування – введення у сталі та інші сплави легуючих компонентів, які здатні утворювати з киснем повітря стійки захисні оксидні плівки. Ними можуть бути нікель, хром, титан, цирконій та ін. За вмістом домішок сталі поділяють на низьколеговані (< 5 %), середньо-леговані (5¸10 %) і високолеговані (> 10 %). Наприклад, стійка у нітратній кислоті сталь 0Х18Н10Т містить 18 % хрому, 10 % нікелю і 1 % титану. У суднобудуванні переважно використовують низьколеговані сталі марок 10ХСНД, 09Г2 (містять силіцій, манган, хром і нікель). Ці сталі недостатньо стійки у морській воді потребують додаткового захисту від корозії.
Питання та задачі
1. Перелічити основні методи захисту від корозії.
2. Які основні методи ізоляції поверхні металу від корозії ви знаєте?
3. Навести основні лакофарбові покриття, що використовуються у кораблебудуванні та побуті.
4. Охарактеризувати основні методи нанесення металевих покрить.
5. Навести приклади нанесення гальванічних покрить.
6. Охарактеризувати гальванічні покриття за значенням потенціалів металів.
7. У яких випадках металічні покриття захищають основний метал від корозії при порушенні суцільності покриття, а у яких - ні?
8. Навести приклади катодного та анодного покриття. Записати схеми утворених корозійних елементів і зробити висновки про захисні властивості покриття.
9. Пояснити явище пасивації. Навести приклади пасиваторів.
10. Охарактеризувати процес оксидування сталей і алюмінію.
11. Пояснити хімічні явища при фосфатуванні сталей.
12. Електрохімічний захист (протекторний і катодний).
13. Інгібітори корозії.
14. Скласти схему корозійного гальванічного елементу, утвореного при порушенні мідного покриття на залізі в морській воді. Написати рівняння електродних процесів. Розрахувати ЕРС та DG0 для цього елемента, якщо стаціонарні потенціали заліза та міді в морській воді відповідно дорівнюють – 0,50 В та - 0,08 В.
15. Скласти схему гальванічного елемента, утвореного при порушенні цинкового покриття на залізі у морській воді. Розрахувати його ЕРС, якщо jм.в.(Fe2+|Fe0) = -0,50 B, jм.в.(Zn2+|Zn0) = -0,8 B, j(O2|OH–) = +0,82 B.
16. При порушенні поверхневого шару цинкового покриття на залізі у морській воді відбувається процес корозії внаслідок роботи гальванічного елементу. Надати схему утвореного елемента, написати катодну та анодну реакції, визначити ЕРС та DG0 елемента, якщо стаціонарні потенціали цинку та заліза в морській воді відповідно дорівнюють –0,83 В та -0,50 В. j(O2|OH–) = = + 0,82 B.
17. Згідно з яким принципом вибирають метали для захисного покриття? Навести приклади металів, що застосовуються у якості анодних покриттів для бронз (Сu-Sn). Написати схеми процесів, що відбуваються при порушенні суцільності гальванічних покрить. Користуватися значеннями стандартних електродних потенціалів металів.
18. Мідь вкрита хромом. Які процеси відбуваються при порушенні суцільності покриття в кислому середовищі? Скласти схему гальванічного елемента, що утворюється. Розрахувати DG0, якщо ЕРС дорівнює 0,93 В.
19. Залізо вкрито нікелем. Яке це покриття? Які процеси відбуваються при порушенні суцільності покриття у вологому повітрі? Скласти схему гальванічного елемента, що утворився та розрахувати його ЕРС, якщо стаціонарні потенціали заліза і нікелю в цих умовах відповідно дорівнюють -0,48 В та +0,10 В. j(O2|OH–) = +0,82 B.
Використана література
1. Глинка Н.Л. Общая химия. - Л.: Химия, 1980-1989.– 680 с.
2. Глинка Н.Л. Задачи и упражнения по общей химии. Учебное пособие для вузов. / Под ред. В.А. Рабиновича и Х.М. Рубиной. - 22-е изд., испр., и доп. Л.: Химия, 1983. - 264 с.
3. Романцева Л.М., Лещинская З.Л., Суханова В.А. Сборник задач и упражнений по общей химии. Учебное пособие для нехим. спец. вузов - 2-е изд., перераб. и доп. - М.: Высш. шк., 1991. - 288 с.
4. Мороз А.С., Ковальова А.Г. Фізична і колоїдна хімія. - Львів: Світ, 1994. – 280 с.
5. Хоникевич А.А. Химия и коррозия в судостроении. Учебное пособие. - Л. Судостроение, 1988. - 224 с.
6. Телегус В.С., Бодак О.І., Заречнюк О.С., Кінжбало В.В. Основи загальної хімії. /За ред. В.С. Телегуса: Підручник – Львів: Світ, 2000 – 424 с.
7. Козак С.І., Никипанчук М.В., Котур М.Г., Григораш В.В. Хімічні основи корозії конструкційних матеріалів. – Львів: Ліга-Прес, 2001. – 240 с.
8. Коровин Н.В. Общая химия. Учеб. для технических напр. и спец. вузов.- 2-е изд., испр. и доп. -М.: Высш. шк., 2000. - 558 с.
9. Ершов Ю.А., Попков А.С., Берлянд А.З., Книжник А.З. Общая химия. Биофизическая химия. Химия биогенных элементов. - М.: Высш. шк., 2000. - 560 с.
10. Физическая химия. В 2 кн. Кн.2. Электрохимия. Химическая кинетика и катализ: Учебн. для вузов / К.С.Краснов, Н.К. Воробьев, И.Н. Годнев и др.; под ред. К.С. Краснова – 3-е изд., испр. – М.: Высш. шк., 2001. – 319 с.
Дата добавления: 2015-09-18; просмотров: 1816;
