Електроліз солей
Лабораторна робота № 11
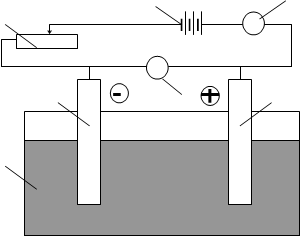
Електролізом зветься сукупність процесів, які відбуваються у електроліті при проходженні електричного струму. При електролізі електрична енергія перетворюється у хімічну. Цей процес проходить у електролізері - пристрої, який складається з послідовно підключених джерела постійного струму, амперметру, вольтметру і електродів, занурених у розчин або розплав електроліту, який знаходиться у електролізній ванні.
 1 2 А 3
1 2 А 3
V
4 5 6
7
Рис 5. Схема приладу для проведення електролізу.
1 - регулятор напруги (реостат); 2 - зовнішнє джерело струму; 3 – амперметр; 4 – катод; 5 – вольтметр, 6 - анод; 7 – електролізна ванна з розплавом або розчином електроліту
У гальванічних елементах внаслідок процесів окислення та відновлення, анод самовільно заряджується негативно, а катод – позитивно.
При електролізі за допомогою зовнішнього джерела струму забезпечується зворотний процес і анод примусово заряджується позитивно, а катод – негативно.
Матеріали катода та анода повинні задовольняти певним вимогам. Катод мусить бути інертним (тобто не реагувати зі складовими електроліту) і вплив його речовини на катодну реакцію повинен бути мінімальним. Анод може бути інертним і активним. Інертні аноди виробляють з благородних металів (Pt, Pd), нержавіючих сталей, графіту.
Для забезпечення процесу електролізу необхідно, щоб зовнішня ЕРС була більшою, ніж ЕРС відповідного гальванічного елементу. Ця різниця витрачається на переборювання опору зовнішнього та внутрішнього кіл. Мінімальна напруга, при якої відбувається процес електролізу зветься напругою розкладу (Uрозк.).
Полярізація електродів
Полярізацією називається зміщення потенціалу електродів від рівноважних значень при проходженні крізь електрохімічну систему електричного струму (відбувається при електролізі та у гальванічних елементах). Існує два типи полярізації – концентраційна та електрохімічна.
Концентраційна полярізація зумовлена тим, що швидкість дифузії гідратованих іонів меньше, ніж швидкість електрохімічних процесів. Цю полярізацію можна зменшити перемішуванням і нагріванням.
Електрохімічна поляризація зв’язана з виникненням гальванічного елементу, ЕРС якого напрямлена протилежно зовнішній ЕРС, що зумовлює процес електролізу.
Катодна полярізація зміщує потенціал катоду до більш негативних значень, анодна полярізація зміщує потенціал аноду до більш позитивних значень.
При електролізі процеси поляризації залежать крім швидкостей руху іонів у електролітах та електронів у провідниках, дифузії гідратованих іонів та електрохімічних процесів ще й від густини струму на електродах. Густина струму і (D) – це відношення величини струму, якій подається у електролізну ванну до площини поверхні електроду.
і ( D) = I / S (А/дм2).
Чим більше густина струму, тим більше поляризація. Для зменшення електрохімічноі полярізації реальну площину поверхні збільшують, використовуючи пористі та губчасті електроди.
У загальному випадку і кат ¹ і ан, тому що найчастіше площини катоду та аноду не дорівнюють одна одній, а до електролизеру поступає струм певної величини. Залежності потенціалів електродів від густини струму відображаються на поляризаційних кривих, вигляд яких може значно змінюватися при зміні умов електролізу, особливо при наявності домішок інших електролітів.
Перенапругою потенціалу електроду, або просто перенапругою h називається різниця потенціалів поляризованого електроду та електроду в рівноважному стані при даній густині струму
h = jі – jрівн.
Катодна перенапруга завжди має знак минус, анодна – знак плюс.
Особливе значення має перенапруга відновлення водню, тому що в водному розчині завжди є іони водню. Вона залежить від матеріалу електрода та стану його поверхні, значення рН, температури. Для деяких електродів вона досягає –2,0 В (j0 (2Н+|Н2) = 0). Найменша вона на губчастому платиновому електроді (jі = jрівн).
Для більшості іонів металів при умові відновлення на електроді тієї ж природи і невеликих значеннях густини струму перенапруга незначна і jі = jрівн.
Процеси на електродах
Порядок розряду іонів на електродах залежить від jі, тобто від значення рівноважного (за стандартних умов - стандартного) потенціалу та від перенапруги. На катодах у першу чергу відновлюються катіони з більшим значенням електродного потенціалу та з найменшим негативним значенням перенапруги. На анодах спочатку окиснюються іони з меншим значенням потенціалу та з найменшим позитивним значенням перенапруги. Якщо немає значень перенапруги відділення конкретного іону, можна орієнтовно користуватися значенням стандартного електродного потенціалу.
Процеси на катодах
При електролізі кислот, солей і основ на катодах відновлюються катіони металів і водню (з води або кислот) за наступними правилами:
1. метали, які стоять у ряді напруг після водню завжди відновлюються з водних розчинів та розплавів у порядку зменшення їх потенціалів (у випадку
Ag+ + ē ® Ag0; j0 = +0,8 В
відновлення металів на металічних електродах той же природи можна використовувати стандартні значення потенціалів).
2. метали, які стоять у ряді напруг до алюмінію включно відновлюються тільки з розплавів
Na+ + 1ē ® Na0 ; j0 = -2,70 В.
З водних розчинів замість них відновлюється водень, тому що потенціал реакції відновлення значно менше потенціалу відновлення водню:
2Н2О + 2е ® Н2 + 2ОН–; j0 = -0,83 В,
або в кислих середовищах 2Н+ + 2ē ® Н2 ; jі = 0,00 … -0,41 В при рН = 1…7).
3. метали, які стоять у ряді напруг від алюмінію до водню теоретично можуть відновлюються на катоді разом з воднем. У більшості випадків реакцію відновлення водню можна довести до мінімуму збільшенням перенапруги іонів водню.
Fe2+ + 2e ® Fe0; j0 = -0,44 В;
Zn2+ + 2e ® Zn0; j0 = -0,76 В.
Процеси на анодах
На анодах відбуваються процеси окиснення відновників у порядку збільшення їх потенціалів. Тому спочатку відбуваються процеси, які характеризуються найменшим значенням потенціалів.
Ці процеси відбуваються згідно з наступними правилами:
1. Розчинні аноди окиснюються з утворенням відповідних іонів металів:
Zn0 – 2ē ® Zn+2; j0 = -0,76 В;
Cu0– 2ē ® Cu+2; j0 = +0,34 В;
Це пояснюється тим, що більшість металів мають менший потенціал окиснення, ніж іони-відновники, які є у електроліті.
2. На нерозчинних анодах (Pt, Pd, C), потенціал яких достатньо великий, відбувається процес окиснення компонентів електроліту згідно зі значеннями потенціалів реакцій:
а) якщо у електроліті є аніони безкисневих кислот, вони окиснюються у першу чергу (крім іонів F–)
2Cl– – 2ē ® Cl2 ; jі = +1,52 В (на платинових електродах);
2І– – 2ē ® І2 ; j0 = +0,53 В.
б) якщо у розчині є іони кисневмісних кислот, то вони не окиснюються на аноді внаслідок великого значення їх електродних потенціалів; замість них на аноді окиснюються молекули води з виділенням кисню:
2SO42– - 2ē ® S2O82– ; j0 = +2,01 В;
2H2O - 4ē ® O2 + 4H+; jі = +1,68 В (на платиновому електроді)
в) у випадку лужного середовища (наявність іонів ОН–) проходить реакція окиснення гідроксид-іонів:
4ОН– - 4ē ® О2 + 2Н2О; jі = 0,4 в
Наведемо декілька прикладів.
1. Електроліз води (інертні електроди, склад електроліту - Н2О)
Дистильована вода електролізу не піддається, тому що є дуже слабким електролітом. Звичайна вода (водопровідна, природна) містить домішки солей, що підвищують її електропровідність і вона легко розкладається.
К: 2Н2О + 2ē ® Н2 + 2ОН–
 А: 2Н2О - 4ē ® О2 + 4Н+
А: 2Н2О - 4ē ® О2 + 4Н+
 2Н2О ел-з 2Н2+ О2.
2Н2О ел-з 2Н2+ О2.
При електролізі води на катоді відновлюється водень, на аноді виділяється кисень. У прикатодному шарі електроліта (католіті) утворюється слабколужне середовище, у прианодному шарі (аноліті) - слабкокисле середовище. Якщо відокремити католіт і аноліт можна отримати слабколужну воду, яку в народі називають “живою”, внаслідок вираженої регенеруючої здатності та слабкокислу воду, яку називають “мертвою”, тому що вона має антисептичні властивості. Електролітичний розклад води - це промисловий спосіб отримання водню та кисню.
2. Електроліз розплаву NaCl (платинові електроди, в електроліті є іони Na+ та Сl–) .
А: 2Сl– – 2ē ® Cl2
K: Na+ +1ē ® Na0

 2NaCl ел -з 2Na + Cl2
2NaCl ел -з 2Na + Cl2
При електролізі розплаву NaCl на катоді утворюється металічний натрій, на аноді - газоподібний хлор. Цей процес є прикладом промислового добування галогенів і активних металів.
3. Електроліз розчину NaCl (платинові електроди, в електроліті є іони Na+, Сl– та молекули води). На аноді можливі два процеси:
А: 1.2Н2О – 4ē = О2 + 4Н+; j0 = 1,23 В ; h = 0,45 В; jі = 1,23 + 0,45 = 1,68 В.
2. 2Cl– – 2ē = Cl2; j0 = 1,36 В; h = 0,16 В ; jі = 1,36 + 0,16 = 1,52 В.
У даному випадку на аноді будуть окиснюватися іони хлору, тому що реальний потенціал окислення хлору менший, ніж потенціал окиснення води.
К: 2Н2О + 2ē ® Н2 + 2ОН–
 А: 2Cl– – 2e ® Cl2
А: 2Cl– – 2e ® Cl2
 2Н2О + 2Cl– ел -з Н2 + 2ОН– + Cl2
2Н2О + 2Cl– ел -з Н2 + 2ОН– + Cl2
 або у молекулярному виді 2Н2О + 2NaCl ел -з Н2 + 2NaОН + Cl2.
або у молекулярному виді 2Н2О + 2NaCl ел -з Н2 + 2NaОН + Cl2.
В цьому процесі на катоді буде виділятися водень, на аноді - хлор, у розчині залишиться NaОН. При випаровуванні воді добувають кристалічний луг NaОН (промисловий спосіб добування лугів).
4. Електроліз розчину Na2SO4 (інертні аноди, склад електроліту: Н2О , Na+, SO42–).
А: 2Н2О - 4ē ® О2 + 4Н+
 К: 2Н2О + 2ē ® Н2 + 2ОН–
К: 2Н2О + 2ē ® Н2 + 2ОН–
 2Н2О ел -з 2Н2 +О2.
2Н2О ел -з 2Н2 +О2.
В результаті електролізу цієї солі буде відбуватися розкладення води й концентрація солі буде зростати.
5. Електроліз солі CuSO4 з розчинними мідними анодами
(склад електроліту - Cu2+, SO42–, Н2О).
А: Сu0 – 2ē ® Cu2+
 K: Cu2+ + 2ē ® Cu0
K: Cu2+ + 2ē ® Cu0
 Сu0 + Cu2+ ел -з Cu2+ + Cu0.
Сu0 + Cu2+ ел -з Cu2+ + Cu0.
В результаті електролізу мідний анод розчинюється, на катоді відновлюється мідь, тобто відбувається перенос речовини міді з аноду на катод. Таким чином в промисловості добувається чиста (рафінована) мідь. Анодами є пластини чорнової (забрудненої) міді, катодами – пластини з рафінованої міді. У процесі електролізу мідь з анодів поступово відкладається на катодах, а домішки залишаються у розчині.
6. Електроліз солі CuSO4 з нерозчинними анодами (склад електроліту - Cu2+, SO42–, Н2О).
А: 2Н2О - 4ē ® О2 + 4Н+
 К: Сu2+ + 2ē ® Cu0
К: Сu2+ + 2ē ® Cu0
 2Н2О + Сu2+ ел -з О2 + 4Н+ + Cu0;
2Н2О + Сu2+ ел -з О2 + 4Н+ + Cu0;
 2Н2О + СuSO4 ел -з О2 + 2Н2SO4 + Cu0.
2Н2О + СuSO4 ел -з О2 + 2Н2SO4 + Cu0.
В цьому процесі відбувається виділення міді на катоді, кисню - на аноді, а у розчині утворюється сульфатна кислота.
Приклад 1. Описати процеси на електродах при електролізі розчину К2SO4.
Електроліз розчину К2SO4 (склад електроліту: Н2О, К+, SO42–).
А: 2Н2О - 4ē ® О2+ 4Н+
 К: 2Н2О + 2ē ® Н2+ 2ОН–
К: 2Н2О + 2ē ® Н2+ 2ОН–
 Сумарний процес: 2Н2О ел -з О2 + 2Н2.
Сумарний процес: 2Н2О ел -з О2 + 2Н2.
В результаті електролізу цієї солі буде відбуватися розклад води і концентрація солі буде зростати, тому що з водних розчинів К+ не буде відновлюватись внаслідок великого від’ємного потенціалу, а іони SO42– не будуть окиснюватися, тому що мають потенціал більше (j0(S2O82–|2SO42–) = 2,01 В), ніж потенціал розкладу води до О2 та Н+ (j0(O2 + 4H+|2H2O) = 1,68 В).
Кількісні характеристики електролізу. Закони Фарадея
Перший закон Фарадея
Маса речовини, яка перетворюється на електродах, пропорціональна кількості електрики струму, що пройшла крізь розчин або розплав електроліту.
m = kQ,
де k – коефіцієнт пропорціональності, який називається електрохімічним еквівалентом перетвореної речовини, Q – кількість електрики, Q = It.
Другий закон Фарадея
Математичним вираз його такий: m = МEIt/ F,
де m - маса перетвореної речовини, г; МE - молярна маса хімічного еквіваленту речовини ( МE = М/n, М - молярна маса речовини, n – кількість електронів у сумарному окисно-відновному процесі); t – тривалість електролізу, секунди або години; F - число Фарадея, 96500 Кл/моль (якщо час виражений у секундах), або 26,5 А.год/моль (якщо час виражений у годинах); І - величина сили струму, А.
Крім головного процесу при проходженні електричного струму крізь електроліт відбувається багато побічних процесів. Частка кількості електрики, яка використовується для добування певного продукту характеризується виходом за струмом. Вихід за струмом - це відношення кількості практично одержаної речовини та кількості теоретично розрахованої речовини згідно з законом Фарадея:
h = mпр/mтеор.
При відновленні таких металів як цинк, мідь, залізо h досягає величини 95¸98 % .
Приклад 2. Визначити час, необхідний для добування 1 кг металічного натрію при електролізі розплаву натрій гідроксиду при силі струму 2500 А. Вихід за струмом (h) дорівнює 35 %. Визначити добутий об’єм кисню.
Розв’язання:
1. Процеси на електродах (склад електроліту: ОH–, Na+).
А: 4ОН– - 4ē ® 2Н2О + О2;
К: Na+ + 1ē ® Na.
2. t - ?
Закон Фарадея: m = ME It/F, t = mF/ME I, ME(Na) = 23 г/моль.З урахуванням виходу за струмом t = mF/hME I; t = (1000 . 96500)/(0,35 . 23 . 2500) = = 4795 с = 1 год, 20 хв.
3. V(O2) - ?
V(O2) = VE I th /F, де VE - молярний об’єм еквіваленту кисню.
VE = 5,6 л/моль. V(O2) = (5,6 × 2500 × 4795 × 0,35) / 96500 = 243,5 л.
Відповідь: t = 1 год, 20 хв; V(O2) = 243,5 л.
Використання електрохімічних процесів у промисловості
Акумулятори
Акумулятори – це оборотні гальванічні елементи. Речовини електродів і електролітів підбирають так, щоб при електролізі оборотність досягалась найменшими збитками енергії на побічні процеси та відділення теплоти. Цим вимогам задовольняють кілька електрохімічних систем.
Найпоширеним з акумуляторів є свинцевий або кислотний. Він складається з двох свинцевих решіток (електродів). До зарядження вічки решіток заповнюють пастою з РbO і гліцерину (як зв’язуюче). Оксид свинцю реагує з розчином сульфатної кислоти (30 %), в який занурено електроди, з утворенням нерозчинного сульфату свинцю: РbO + H2SO4 = PbSO4 + H2O.
Акумулятор заряджують, приєднавши його до джерела постійного електричного струму. При зарядженні відбувається процес електролізу й електрична енергія перетворюється на хімічну:
А (+): PbSO4 + 2H2O - 2ē ® PbO2 + 4H+ + SO42–
 К (–): PbSO4 + 2ē ® Pb0 + SO42–
К (–): PbSO4 + 2ē ® Pb0 + SO42–
2PbSO4 + 2H2O ® PbO2 + Pb0 + 2H2SO4.
При пропусканні постійного струму крізь цю систему на позитивному електроді (аноді) Pb2+ окиснюється з утворенням PbO2, на негативному електроді (катоді) Pb2+ відновлюється з утворенням Pb.
Заряджений акумулятор можна зараз же використовувати, як гальванічний елемент. Схема його така:
(–) Pb0| PbSO4 || PbSO4 |PbO2 (+).
Під час розрядки акумулятора на електродах проходять відповідні оборотні процеси і хімічна енергія перетворюється на електричну:
А (–): Pb0 + SO42– - 2ē ®PbSO4
 K (+): PbO2 + 4H+ + SO42– + 2ē ® PbSO4 + 2H2O
K (+): PbO2 + 4H+ + SO42– + 2ē ® PbSO4 + 2H2O
PbO2 + Pb0 + 2H2SO4 ® 2PbSO4 + 2H2O.
Його ЕРС відрізняється стабільністю і дорівнює 2,001 в. Ступінь розрядження акумулятора визначають за зменшенням густини кислоти, оскільки її концентрація внаслідок утворення PbSO4 зменшується. При зменшенні ЕРС до 1,85 В акумулятор заряджають знов.
Ці акумулятори дуже широко використовуються у промисловості (»90 % від загальної кількості вироблених пристроїв).
Долужних акумуляторів належать залізно-нікелевий, кадмій-нікелевий, срібно-цинковий. Електролітом є 20¸30%-ний розчин КОН або LiOH. Схема його така:
(–)Fe|розчин KOH|Ni(OH)3 (+); ЕРС = 1,36 В.
A: Fe0 –2ē ® Fe2+
К: Ni3+ + ē ® Ni2+.
Принцип дії залізно-нікелевого акумулятора також можна виразити рівнянням:
 Fe + 2Ni(OH)3 розрядження Fe(OH)2 + 2Ni(OH)2.
Fe + 2Ni(OH)3 розрядження Fe(OH)2 + 2Ni(OH)2.
зарядження
При порушенні герметичності речовини електродів та електролітів потрапляють у навколишнє середовище, що призводить до його забруднення, тому ці джерела струму є екологічно небезпечні.
Добування алюмінію. Алюміній добувають електролізом розплавленої суміші глинозему та кріоліту ( Al2O3 + Na3[AlF6] ) при температурі 1000 °С. Кріоліт додають для підвищення електропровідності та для зниження температури розплаву. Глинозем при цій температурі дисоціює на іони:
Al2O3 « Al3+ + AlO33–.
Анодами є товсті графітові стрежні, катодом – залізний корпус ванни, футерований графітом. Електродні процеси такі:
А: 4AlO33– – 12ē ® 2Al2O3 + 3O2
K: Al3+ + 3ē ® Al0.
Гальванопластика і гальваностегія
Гальванопластика – процес виготовлення точних копій виробів з металів, пластмас шляхом нанесення електрохімічного покриття, яке легко відокремлюється від основи. Гальванопластика широко застосовується при виготовленні матриць у поліграфії, пресформ і т.п. Цим методом виробляють фольгу, ювелірні вироби, копії скульптур, гравюр, деталі машин складної конфігурації. Товщина осадженого металу коливається від 0,1 ¸ 10,0 мм.
Процес гальванопластики складається з кількох операцій: виготовлення оригіналів, нанесення електропровідного шару, електролізу та відділення форми від покриття.
Гальваностегія – процес нанесення металевого покриття на метали шляхом електролізу. В основному ці покриття наносяться з декоративною метою або з метою захисту металів від корозії і будуть розглядатися у відповідному розділі. Основна різниця обох процесів складається у тому, що у гальванопластиці покриття відокремлюють від основи, а у гальваностегії покриття повинно міцно з’єднатися з основою.
Питання та задачі
1. Що називається електролізом?
2. Які бувають типи поляризації?
3. Чим зумовлена концентраційна поляризація?
4. Від чого залежіть електрохімічна поляризація?
5. Що таке перенапруга і як вона впливає на потенціал конкретної реакції?
6. Поясніть, чому особливе значення має перенапруга відділення водню для електролізу водних розчинів і від чого вона залежить?
7. Сформулюйте правила відновлення на катодах. Від чого залежать ці процеси?
8. Сформулюйте правила окиснення на катодах. Які процеси можуть відбуватися на розчинних і нерозчинних анодах? Чим вони зумовлені?
9. Записати схеми електролізу наступних розплавів: КСl, NaBr, MgCl2, RbI.
10. Записати схеми електролізу наступних розчинів з нерозчинними анодами: K2SO4, MgSO4, CuCl2, NiBr2, FeCl2, Na2SO4 +CuI2.
11. Записати схеми електролізу наступних розчинів з розчинними анодами: FeCl2, CuCl2, NiSO4, Co(NO3)2, AuCl3.
12. Крізь розчин ZnСl2 пройшло 96500 Кл електрики. При цьому маси виділених цинку та хлору відповідно дорівнюють 19,61 та 6,20 г. Записати електродні процеси та розрахувати вихід за струмом.
13. При електролізі солі двовалентного металу струмом силою 1 А протягом 1 год виділилось на катоді 2,219 г металу. Визначити цей метал.
14. При пропусканні струму протягом 9 хвилин крізь кулонометр, який містить розведений розчин Н2SО4, виділилося 0,06 г гримучого газу 2Н2+О2, виміряного при температурі 20 °С та тиску 99708 Па. Навести повну схему електролізу розчину Н2SО4 та визначити силу струму.
Дата добавления: 2015-09-18; просмотров: 2723;
