ГІДРОЛІЗ СОЛЕЙ
До реакцій обміну в розчинах належить взаємодія між кислотами і основами, в результаті якої утворюється сіль і вода. Такі реакції називаються реакціями нейтралізації. Вони йдуть до кінця тільки тоді, коли реагують сильні основи і кислоти. Наприклад:
HCl + KOH ® KCl + H2O;
H+ + Cl- +K+ + OH- ® K+ + Cl- + H2O;
H+ + OH- ® H2O.
Скорочене іонне рівняння показує, що рівновага практично повністю зміщується в сторону утворення води. Нейтралізація кислот і основ, різних за силою, до кінця не відбувається. Наприклад:
CH3COOH + KOH « CH3COOК + H2O;
CH3COOH + OH- « CH3COO- + H2O;
HCl + NH4OH « NH4Cl + H2O;
H + + NH4OH « NH4+ + H2O.
Ці реакції оборотні, тому що малодисоційовані сполуки утворюються в результаті прямої і зворотної реакцій.
Реакція, зворотна реакція нейтралізації, тобто взаємодія солі з водою з утворенням кислоти і основи, називається гідролізом солі.
Причиною гідролізу є участь у реакції слабкої основи і кислоти. При цьому катіон солі (відповідний слабкій основі) поляризує молекулу води і зв’язує гідроксильний іон. Визволений іон Н+ утворює кисле середовище (рН < 7). Навпаки, аніон солі, відповідний слабкій кислоті, зв’язує іон Н+ води і визволяє іон ОН- (рН > 7).
Розглянемо гідроліз різних солей.
1. Солі сильної кислоти і сильної основи гідролізу не підлягають, рН » 7 (NaCl; Ba(NO3)2; K2SO4).
2. Солі сильної кислоти і слабкої основи гідролізуються зі збільшенням концентрації Н+:
NH4NO3 + H2O « NH4OH + HNO3;
NH4+ + H2O « NH4OH + H+; pH < 7.
3. Солі слабкої кислоти і сильної основи гідролізуються зі збільшенням концентрації ОН-:
KCN + H2O « KOH + HCN;
CN- + H2O « OH- + HCN; pH > 7.
4. Солі слабких кислот і основ гідролізуються, і рН розчину залежить від їх відносної сили і взагалі близький до 7:
CH3COONH4 + H2O « NH4OH + CH3COOH;
CH3COO- + NH4+ + H2O « NH4OH + CH3COOH; pH » 7.
5. Гідроліз солей багатоосновних кислот або багатокислотних основ відбувається ступінчасто:
а) K3PO4 + H2O « K2HPO4 + KOH;
PO43- + H2O « HPO42- + OH-; pH > 7;
K2HPO4 + H2O « KH2PO4 + KOH;
HPO42- + H2O « H2PO4- + OH-; pH > 7,
гідроліз до кінця не проходить, тому що накопичення іонів ОН- заважає утворенню Н3РО4;
б) FeCl3 + H2O « FeOHCl2 + HCl;
Fe3+ + H2O « Fe (OH)2+ + H+; pH < 7;
FeOHCl2 + H2O « Fe(OH)2Cl + HCl;
Fe(OH)2+ + H2O « Fe(OH)2+ + H+; pH < 7,
накопичення іонів Н+ заважає утворенню Fe(OH)3 по третьому ступеню;
в) гідроліз солей дуже слабких основ і кислот (Al2S3, Cr2S3, Al2(CO3)3…) відбувається до кінця. В розчині такі солі не існують (в таблиці розчинності їх позначають знаком "-");
Cr2S3 + 6H2O = 2Cr(OH)3Ї + 3H2S; pH » 7;

 Fe(CO3)3 + 6H2O = 2Fe(OH)3Ї + 3H2CO3; pH » 7.
Fe(CO3)3 + 6H2O = 2Fe(OH)3Ї + 3H2CO3; pH » 7.
3H2O 3CO2
Кількісно гідроліз у розбавлених розчинах характеризується константою гідролізу. Наприклад, гідроліз NaCN:
NaCN + H2O « NaOH + HCN; CN-+ Н2О « HCN + OH-.
Це – оборотний процес, тому йому відповідає константа рівноваги
К = 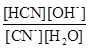 .
.
Для розбавлених розчинів [H2O]>>[HCN], тоді можна вважати, що [H2O] = const,
K.[H2O]= Kг = 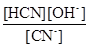 =
= 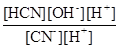 =
= 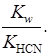
В цьому випадку константа гідролізу Кг = Kw/Kкис. Для солі слабкої основи і сильної кислоти Kr = Kw/Kосн, для солі слабкої основи і кислоти Kr = Kw/(Kкис . Kосн).
Ступінь гідролізу bг - відношення числа гідролізованих молекул до загального числа молекул солі в розчині – звўязаний з константою гідролізу співвідношенням br = 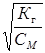 , де СМ - молярна концентрація солі.
, де СМ - молярна концентрація солі.
Згідно з принципом ле Шательє розбавлення розчину солі і підвищення температури посилює гідроліз
Приклад 1. Визначити Kr і br для 0,1М розчину Na3PO4 (константи дисоціації H3PO4 відповідно дорівнюють K1 = 7.10-3; K2 = 6.10-8; K3 = 4.10-13).
Розвўязок:
1. Кг1 - ? br1 - ?
PO43- + H2O = HPO42-+ OH-. Гідроліз по першому ступеню повўязаний з дисоціацією кислоти по третьому ступеню (HPO42- = H+ + PO43-) і K3. Тому
Kr1 = Kw/K3 = 10-14 / 4.10-13 = 0,025;
br1 = 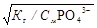 =
= 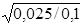 = 0,5 (50 %).
= 0,5 (50 %).
2. Кг2 - ? bг2 - ?
HPO42- + H2O = H2PO41- + OH-
Kr2 = Kw/K2 = 10-14 / 6.10-8 = 1,67.10-7;
br2 = 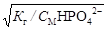 =
= 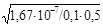 = 1,84.10-7 (0,184 %);
= 1,84.10-7 (0,184 %);
CМ(HPO42-) = 0,1. 0,5, тому що br1 = 50 %, тобто 50 % Na3PO4 перетворилось у Na2HPO4.
Відповідь: Kr1 = 0,025, br1 = 50 %, Kr2 = 1,67.10-7, br2 = 0,184 %.
Дата добавления: 2015-09-18; просмотров: 1965;
