РОЗЧИНИ ЕЛЕКТРОЛІТІВ
Розчини кислот, солей i основ у полярних розчинниках внаслiдок дисоцiацiї з утворенням катiонiв i анiонiв проводять електричний струм. Речовини, якi утворюють розчини, що мають iонну провiднiсть, називаються електролiтами. Розчини електролiтiв часто називають електролiтами. Здатнiсть електролiту дисоцiювати характеризується ступенем дисоцiацiї a – вiдношенням кількості продисоцiйованих молекул до загальної кількості молекул розчиненої речовини.
До сильних електролiтiв належать майже всi солi, деякi кислоти (HCl, HBr, HI, HNO3, H2SO4, HClO4, HMnO4) i основи – гiдроксиди лужних i лужно-земельних металiв. Решта електролiтiв належить до слабких.
Дисоцiацiя слабкого електролiту – оборотний процесс, який призводить до встановлення хiмiчної рiвноваги. Наприклад: HCN « H+ + CN-. Константа рiвноваги в даному випадку називається константою електролiтичної дисоцiацiї:
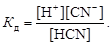
Якщо молярна концентрацiя HCN дорiвнює С, а ступiнь дисоцiацiї - a, тодi
[H+] = [CN-] = Ca, [HCN] = C – aC = C(1 - a).
K д = CaCa/a 2C = a2C/1 - a.
Якщо a << 1, то Kд = a2C.
Це є закон розбавлення Оствальда для електролiту складу KA (K+i A-– однозаряднi катiон i анiон); Kд - величина, характерна для системи "речовина - розчинник" і залежить тiльки від температури.
Приклад І. Розрахувати концентрацію іонів H+ в 0,1 н. розчині ацетатної кислоти (Кд = 1 · 10-5).
Розв’язок:
З рівноваги CH3COOH « CH3COOЧ + H+ маємо: [H+] = [CH3COO-] = C.a .
Із закону Оствальда, 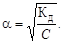 Тоді [H+] = C
Тоді [H+] = C 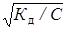 =
=
= 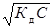 =
= 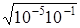 = 10-3 моль/л.
= 10-3 моль/л.
Відповідь: [H+] = 10-3 моль/л.
Багатоосновні кислоти дисоціюють ступінчасто:
H3PO4 « H+ + H2PO4-; K1 = 7,5 · 10-3 ;
H2PO4-- « H+ + HPO42-; K2 = 6,4 · 10-8 ;
HPO4 2-« H+ + PO43-; K3 = 1,3 · 10-13 .
Дисоціація по першому ступеню відбувається інтенсивніше, ніж по другому, а тим більше - по третьому. Це пояснює здатність багатоосновних кислот утворювати кислі солі. Ступінчасто дисоціюють також багатокислотні основи, що призводить до утворення основних солей. Наприклад:
Fe(OH)3 « Fe(OH)2+ + OH- ;
Fe(OH)2+ « Fe(OH)2+ + OH- ;
Fe(OH)2+ « Fe3+ + OH-.
В розчинах електролітів загальне число частинок розчиненої речовини (молекул, іонів) більше, ніж у розчинах неелектролітів тієї ж концентрації. Тому такі властивості, як осмотичний тиск Pосм, зниження тиску пари DP, підвищення температури кипіння Dtкип і зниження температури замерзання Dtзам, проявляються більшою мірою. Їх можна розрахувати, користуючись рівняннями:
DP = i PoNB; Dtкип = і КебСm; Dtзам= і КкрСm; Pосм = і СМRT.
Тут Po - тиск пари чистого розчинника; Nв– мольна доля розчиненої речовини; Кеб і Ккр – ебуліоскопічна і кріоскопічна сталі розчинника; Сm - моляльність розчину; СМ – молярність розчину, і – ізотонічний коефіцієнт, який показує, у скільки разів зросла кількість частинок розчиненої речовини в розчині відносно кількості її молекул.
Розчини сильних електролітів повністю дисоціюють на іони, і для них a має дорівнювати одиниці. Проте для концентрованих розчинів (> 0,1М) сильних електролітів a <1. Це пов’язано з електростатичною міжіонною взаємодією. Експериментальне значення a сильних електролітів називається позирним ступенем дисоціації і позначається aпоз.
Ступінь дисоціації aпоз та ізотонічний коефіцієнт і зв’язані між собою рівнянням:
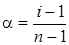 або
або 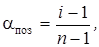
де n – кількість іонів, на які дисоціює електроліт.
Приклад 2. Визначити позирний ступінь дисоціації LiCl у 0,1 н. розчині, якщо цей розчин ізотонічний з 0,19М розчином цукру С12Н22О11 при 0 °С.
Розв'язок:
1. Росм розчину цукру - ?
М (С12Н22О11) = 342,3 г/моль;
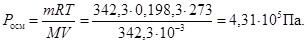
2. Росм розчину LiCl - ?
Розчини С12Н22О11 і LiCl ізотонічні, тому їх осмотичні тиски дорівнюють один одному. Росм розчину LiCl = 4,31.105 Па.
3. і розчину LiCl - ?
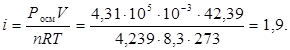
4. a поз - ?
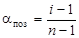 =
= 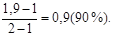
Відповідь: позирний ступінь дисоціації дорівнює 90 %.
Електроліти у розчині більше або менше дисоційовані, тому реакції між розчинами солей, основ, кислот – це реакції між іонами, тобто іонні реакції. В рівняннях іонних реакцій сильні електроліти записуються в іонній формі, слабкі – в молекулярній (слабкі електроліти записують в іонній формі тільки в реакціях дисоціації). Речовини важкорозчинні та гази записують у вигляді молекул.
Реакції в електролітах йдуть до кінця лише в тих випадках, коли з розчину виходять ті чи інші іони внаслідок утворення важкорозчинних (СаСО3, ВаSO4), малодисоційованих (Н2О, СН3СООН), газів (СО2, Н2S), або комплексних сполук ([Fe(CN)6]3-). Наприклад:
Na2SO4 + BaCl2 ® 2NaCl + BaSO4Ї;
2Na+ + SO42- + Ba2+ + 2Cl- ® 2Na+ + 2Cl- + BaSO4Ї;
Ba2+ + SO42- ® BaSO4Ї;
Na2CO3 + 2HCl ® 2NaCl + CO2 + H2O;
2Na+ +CO32- + 2H+ + 2Cl- ® 2Na+ + 2Cl- + CO2+ H2O;
CO32- + 2H+ ® CO2 + H2O;
CuSO4 + 4NH3 ® [Cu(NH3)4]SO4;
Cu2+ +SO42- + 4NH3 ® [Cu(NH3)4]2+ + SO42-;
Cu2++ 4NH3® [Cu(NH3)4]2+.
Вода – слабкий електроліт, який дисоціює з утворенням іонів Н+ (Н3О+) і ОН-
Н2О « Н+ + ОН- або 2Н2О « Н3О+ + ОН-.
Дата добавления: 2015-09-18; просмотров: 2200;
