Хімічна рівновага
В основному хімічні реакції є оборотними, тобто можуть одночасно проходити в двох взаємно протилежних напрямках. Якщо швидкості прямої і зворотної реакції рівні, в системі встановлюється хімічна рівновага, яка при даній температурі характеризується константою рівноваги. Так, для реакції
аА + вВ « сС + dD
константа рівноваги виражається рівнянням:
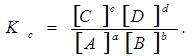
Відповідно до закону діючих мас (ЗДМ) константа рівноваги будь-якої (простої чи складної) оборотної реакції – величина стала при сталій температурі. Вона може бути розрахована, якщо відомі вихідні концентрації речовин і рівноважна концентрація одного з реагентів.
Приклад 4. Для реакції A + 2B « L + 3M вихідні концентрації становлять: [A] = 2 моль/л; [B] = 3 моль/л, а рівноважна концентрація [L] = 0,5 моль/л. Визначити Кс (загальний об’єм залишається постійним).
Розв’язок:
З рівняння реакції видно, що 0,5 моля L отримується із 0,5 моля A і 1 моля B; при цьому утворюються 1,5 моля M. Тоді при рівновазі [A] = 2 – 0,5= 1,5 моль/л; [B] = 3 – 1 = 2 моль/л; [L] = 0,5 моль/л; [M] = 1,5 моль/л.
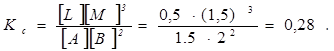
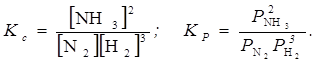
Константу рівноваги можна виразити і через парціальний тиск. Так, для реакції N2(г.) +3H2(г.) « 2NH3 (г.)
При цьому КP = KC(RT)Dn, де Δn - зміна числа газоподібних молекул у реакції.
Константа рівноваги пов’язана зі стандартною енергією Гіббса реакції
DG° = – RT. ln KР.
Це співвідношення дозволяє, якщо є енергія Гіббса реакції, розрахувати константу рівноваги і навпаки.
Принцип ле Шательє. Якщо на систему, яка знаходиться в рівновазі, подіяти зовнішнім фактором, то в ній виникають процеси, що зменшують цей вплив. Так, зміна температури змінює K: підвищення її зміщує рівновагу у бік ендотермічної реакції, зниження – у бік екзотермічної. Зміна тиску зміщує рівновагу газових реакцій при Δn ? 0: підвищення – в напрямку процесу, який супроводжується зменшенням числа молекул газів (об’єму), зниження – у бік збільшення числа молекул газів (об’єму).
Введення каталізаторів у рівноважну систему не може викликати зміщення рівноваги, тому що каталізатор прискорює і пряму, і зворотну реакції, прискорюючи процес досягнення рівноваги.
Питання і задачі
1. Що називається швидкістю хімічної реакції?
2. Як описується залежність швидкості реакції від концентрації реагуючих речовин для простих і складних реакцій?
3. Що таке порядок і молекулярність реакції? Коли вони тотожні?
4. Константа швидкості хімічної реакції.
5. Правило Вант-Гоффа. Рівняння Арреніуса. Чому швидкість реакції збільшується з підвищенням температури?
6. Що таке каталіз? Яка його суть?
7. Що таке хімічна рівновага? Константа рівноваги, її зв’язок з енергією Гіббса.
8. Написати закон діючих мас для реакцій:
2NO + O2 « 2NO2; N2 + 3H2 « 2NH3; H2CO3 « H2O + CO2.
9. Сформулювати принцип ле Шательє. Як збільшити вихід SO3 в реакції SO2 + O2 «2SO3; ΔH°реак = -179 κДж.
10. Визначити температурний коефіцієнт швидкості реакції розкладу мурашиної кислоти на СO2 і H2 в присутності золотого каталізатора, якщо константа швидкості при 413 K дорівнює 5,5.10-4 c-1, а при 458 K дорівнює 9,2.10-3 c-1.
11. Енергія активації реакції N2O5 ®N2O4 + 0,5O2 дорівнює 103,5 кДж/моль. Константа швидкості цієї реакції при 298 K дорівнює 2,0310-3 c-1 Вирахувати константу швидкості цієї реакції при 288 K.
12. Об’ємний склад реакційної суміші в момент рівноваги для реакції
2СО2(г.) « 2СО(г.) + О2(г.) був такий: 88,72 % CO2; 7,52 % CO; 3,76 % O2. Знайти KP і KC для цієї реакції, якщо загальний тиск у системі при температурі 273 К дорівнює 1,01133 .105 Па.
Лабораторна робота № 6
Дата добавления: 2015-09-18; просмотров: 1263;
