Хімічна кінетика
Розділ хімії, який розглядає швидкості і механізми хімічних процесів, називається хімічною кінетикою. Швидкість хімічної реакції - число елементарних актів взаємодії за одиницю часу. Для гомогенних реакцій швидкість визначається як зміна концентрацій вихідних речовин або продуктів реакції за одиницю часу.
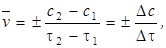
|
Середня швидкість реакції в проміжках часу Dt = t2 – t1
де Dc = c2 - c1 – зміна концентрації.

|
Для продуктів реакції перед відношенням ставиться знак "плюс" , для вихідних речовин – знак "мінус". Істинна швидкість реакції в момент часу t.
Швидкість реакції залежить від природи реагуючих речовин, їх концентрації, температури, наявності каталізатора.
Вплив концентрації. Порядок і молекулярність реакції
Залежність швидкості реакції від концентрації реагуючих речовин описується кінетичним рівнянням, яке визначається експериментально.
Для реакції aA + bB = Cc + dD; v = kCАnACBnB, де СА і СВ - концентрації компонентів А і В; nAі nB– порядки реакції по компонентах А і В.
Порядком реакції по даному компоненту називається показник ступеня при концентрації цього компонента в кінетичному рівнянні- Загальний порядок реакції n дорівнює сумі порядків реакції по окремих компонентах: n = nA + nB; k – константа швидкості реакції, яка чисельно дорівнює швидкості реакції при концентрації реагуючих речовин чи їх добутку, що дорівнює 1; значення k не залежить від концентрацій реагуючих речовин і є сталим при сталій температурі.
Кінетичне рівняння залежить від механізму реакції, тобто від того, через які стадії відбувається даний процес. Якщо реакція відбувається в одну стадію, вона називається простою. Найчастіше реакції є складними, тобто перетворення вихідних речовин у кінцеві проходить через ряд елементарних стадій.
Для простих реакцій чи елементарних стадій справедливий закон діючих мас: при постійній температурі швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин у ступенях, що дорівнюють їх стехіометричним коефіцієнтам.
Наприклад, для реакції Н2 + І2 ®2НІ, яка є простою реакцією першого порядку по Н2 і І2, сумарний порядок дорівнює 2, кінетичне рівняння має вигляд v = k[H2][I2].
Для складних реакцій кінетичне рівняння не відповідає стехіометричному. Так, для реакції 2N2O5 = 4NO2 + O2 кінетичне рівняння таке: v = k[N2O5]. Реакція відбувається через стадії:
N2O5 = N2O3 + O2; (1)
N2O5 + N2O3 = 4NO2. (2)
Перша стадія, більш повільна, лімітує швидкість усієї реакції і визначає її перший порядок по N2O5.
Число молекул, які беруть участь в елементарному акті хімічного перетворення, називається молекулярністю. Так, перша стадія – мономолекулярна, друга - бімолекулярна. Для простих реакцій порядок і молекулярність співпадають, для складних - не співпадають.
Приклад 1. Визначити вид кінетичного рівняння для реакцій в газовій фазі:
A + B + 2D = F + L, якщо при збільшенні концентрації СА в 2, 3, 4 раза швидкість реакції v збільшилась в 2, 3, 4 рази, при такому ж збільшенні CB не змінилась, а CD – збільшилось в 4, 9, 16 разів. Як зміниться швидкість реакції при збільшенні тиску в 2 рази?
Розв’язок:
З умови задачі виходить, що v залежить прямо пропорційно від CA, не залежить від CB і пропорційна квадрату CD, тобто v = kCA1CB0CD2. Отже, реакція першого порядку - по A, нульового - по B, другого - по D. Загальний порядок реакції дорівнює 1+ 0 + 2 = 3.
При підвищенні тиску в 2 рази концентрація кожної речовини в газовій фазі зростає в 2 рази. Тоді
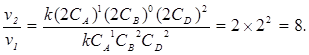
Відповідь: кінетичне рівняння має вигляд v = k CA1CB0CD2; швидкість реакції збільшується в 8 разів.
Вплив температури

|
В більшості випадків швидкість реакції збільшується при підвищенні температури. Згідно з правилом Вант-Гоффа, при збільшенні температури на 10 оС швидкість реакції збільшується в 2–4 рази, тобто
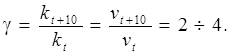
Правило Вант-Гоффа можна також виразити так:
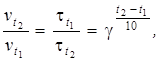
де γ - температурний коефіцієнт швидкості реакції, який показує, в скільки разів підвищується швидкість реакції при збільшенні температури на 10°.
Приклад 2. Визначити, в скільки разів збільшиться швидкість реакції при збільшенні температури на 40 оС, якщо температурний коефіцієнт швидкості цієї реакції дорівнює 3.
Розв’язок:

Згідно з правилом Вант-Гоффа розраховуємо відношення швидкостей при збільшенні температури:
Відповідь: швидкість реакції збільшиться в 81 раз.
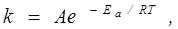
Залежність константи швидкості від температури встановлюється рівнянням Арреніуса:

|
де А - передекспоненціальний множник, який характеризує загальне число співударів молекул, сприятливих у просторовому відношенні;
Еа – енергія активації, Дж/моль – різниця між енергією, необхідною для взаємодії, і середньою енергією молекул; Т – абсолютна температура; R – універсальна газова стала; 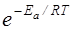 -- доля активних зіткнень.
-- доля активних зіткнень.
Збільшення швидкості реакції з підвищенням температури пов’язане з зростанням числа активних молекул.
Приклад 3. Розрахувати енергію активації реакції, якщо при температурі Т1 = 273 К константа рівноваги k дорівнює 4,04.10-5 c-1, а при T2 = 280 K k = 7,72.10-5 c-1.
Розв’язок:
Використовуємо рівняння Арреніуса.

R = 8,3 Дж/(моль К); lnA = 2,3. lgA;
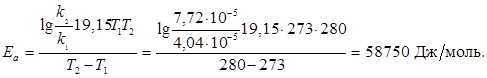
Відповідь: енергія активації дорівнює 58750 Дж/моль.
Дата добавления: 2015-09-18; просмотров: 1173;
