Дисоціація і стійкість комплексних сполук.
Іони зовнішньої сфери зв’язані з комплексом в основному силами електростатичної взаємодії (тобто іонним хімічним зв’язком) і в розчинах дисоціюють подібно сильним електролітам. Ця дисоціація називається первинною і відбувається майже повністю:
[Cu(NH3)4]SO4 « [Cu(NH3)4] 2+ + SO4 2-.
Поряд з цим процесом у незначному ступені відбувається дисоціація внутрішньої сфери комплексу, в якої ліганди повўязані з комплексоутворювачем ковалентними зв’язками, утвореними внаслідок донорно-акцепторної взаємодії:
[Cu(NH3)4] 2+ « Cu2+ + 4 NH3.
Встановлюється рівновага між комплексом, комплексоутворювачем і лігандами. Використовуючи закон діючих мас до цього рівняння, визначаємо вираз для константи дисоціації, яка в даному випадку називається константою нестійкості комплексного іона:
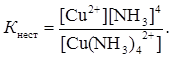
Значення констант нестійкості коливаються в широких межах і є мірою стійкості комплексів. Чим стійкіше комплексний іон, тим менше його константа нестійкості. Так, серед однотипних сполук:
[Ag(NO2)2]- (К нест = 1,3 .10-3);
[Ag(CN)2]- (К нест = 1. 10-21);
[Ag(NH3)2]+ (К нест = 6,8 .10-8);
[Ag(S2O3)2]3- (К нест = 1.10-13).
найбільш стійким є комплекс [Ag(CN)2]- , а найменш – [Ag(NO2)2]-.
Значення констант нестійкості надаються в таблицях.
Приклад 3. Визначити концентрацію Ag+ в 0,005М розчині К[Ag(CN)2], який вміщує, крім того, 0,01 моля КCN в 1 л розчину.
Розв’язок:
Дисоціація комплексу відбувається за рівнянням:
[Ag(CN)2]- « Ag+ + 2CN- .
В присутності надлишку іонів CN-, утворених внаслідок дисоціації КСN, рівновага зміщується у бік недисоційованого комплексу, і кількістю CN-, утворених при дисоціації [Ag(CN)2]-, можна нехтувати.Тоді
[CN-] =[КСN] = 0,01 моль/л.
З тієї ж причини можна прийняти, що [Ag(CN)2]- = 0,05 моль/л, тоді
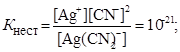
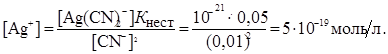 Відповідь: концентрація іонів Ag + дорівнює 5.10-19 моль/л.
Відповідь: концентрація іонів Ag + дорівнює 5.10-19 моль/л.
Ïèòàííÿ ³ çàäà÷³
1. Які сполуки називаються комплексними? Як можна їх одержати?
2. Записати рівняння одержання сполук і назвати їх: Na2[ Zn(OH)4 ] ;
[Ag(NH3)2]NO3; K4 [Fe(CN)6]; [Cu(H2O)4]SO4.
3. Визначити внутрішню і зовнішню сфери, ліганди, комплексоутворювачі в сполуках: [PdCl(H2O)(NH3)2]Cl; [CoCN(H2O)(NH3)4]Br2; [Ni(NH3)6]Cl2; K2[Cu(CN)4]; K2[Pt(OH)5Cl].
4. Координаційне число OS4+ і Ir4- дорівнює 6. Складіть координаційні формули і напишіть рівняння дисоціації в розчині таких комплексних сполук:
2NaNO2 . OsCl4; 2RbCl . IrCl4; OsBr4 . Ca(NO3)2; 2KCl . Ir(NO3)4 .
5. Є комплексна сіль Ba(CN)2 . Cu(CNS)2 . При дії розчину H2SO4 весь барій осаджується у вигляді BaSO4. Напишіть координаційну формулу цієї солі. Скільки комплексної солі було в розчині, якщо взаємодіяло 0,125 л 0,25 н H2SO4?
6. Вирахувати концентрацію іонів кадмію в 0,1М розчині K2[Cd(CN)4], який має, крім того, 6,5 г/л KCN, Кнест[Cd(CN)4]2- = 7,7.10-18.
7. Розглянути будову іона [CoCl4]2- з позицій методу валентних зв‘язків.
Дата добавления: 2015-09-18; просмотров: 2958;
