Константа дисоціації при 20-25 °С
Кд = ([H+][OH-]) / [H2O] = 1,8 .10-16.
Оскільки ступінь дисоціації дуже малий, концентрація води практично стала: [H2O] = const = 1000/18 = 55,5 моль/л.Тоді Кд[H2O] = 1,8 10-16 . 55,5 = 10-14. Добуток Кд[H2O] називається іонним добутком води і позначається Кw. Кw = [H+][OH-] = 10-14.
В чистій воді [H+] = [OH-] = 10-7 моль/л. При додаванні кислоти збільшується концентрація [H+] і зменшується концентрація іонів [OH-], при додаванні лугу – навпаки.
На практиці для характеристики кислотності середовища використовують водневий показник рН = -lg [H+]. Так, в чистій воді [H+] = [OH-] =10-7; pH = 7; в кислому середовищі [H+] > [OH-], pH < 7; в лужному середовищі [H+] < [OH-], pH > 7.
Приклад 3. Вирахувати рН 0,05 %-го розчину NaOH, вважаючи, що густина розчину і ступінь дисоціації NaOH дорівнюють одиниці.
Розв’язок.
1. m розч (NaOH) - ?
Вважаємо, що маємо 1л розчину лугу, його маса m(розч) = Vr =
= 1000мл . 1г/мл = 1000 г.
2. m (NaOH) - ?
m (NaOH) = m(розч) . w(розч) = 1000 . 0,0005 = 0,5 г.
3. См(NaOH) - ?
СNaOH = 0,05/40 = 0,0125 моль/л.
4. [OH-] - ?
Ступінь дисоціації NaOH дорівнює одиниці, тому [OH-] = СNaOH, тобто [OH-] = 0,0125 моль/л.
5. [H+] - ?
[H+]= 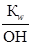 =
= 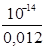 = 8·10-13 моль·іон/л.
= 8·10-13 моль·іон/л.
6. pH - ?
рН = - lg [H+] = - lg 8·10-13 = 12,1.
Відповідь: рН розчину дорівнює 12,1.
Питання і задачі
1. Що таке ступінь і константа дисоціації? Напишіть рівняння дисоціації таких сполук: H2SO3, Al(OH)3, K2SO4, Na3PO4, NH4H2PO4, Al(OH)2Cl.
2. Які електроліти належать до слабких і які до сильних?
3. Сформулюйте закон розбавлення Оствальда.
4. Що таке позирний ступінь дисоціації?
5. Запишіть рівняння, яке пов’язує ступінь дисоціації, та ізотонічний коефіцієнт.
6. Визначити осмотичний тиск 0,01 н. розчину MgCl2 при 18 °С, якщо позирний ступінь дисоціації цього електроліту дорівнює 66 %.
7. Що таке іонний добуток води і pH? Вирахувати pH 0,15 н. розчину ацетатної кислоти (Kд = 1,0.10-5), 0,15 н. розчину HСl.
8. Визначити молярну концентрацію KOH, якщо pH розчину дорівнює 10.
9. Константа дисоціації HNO2 дорівнює 5,1.106. Визначити ступінь дисоціації її у 0,01М розчині і концентрацію іонів водню.
10. Визначити a і концентрацію іонів ОН- у 0,1 н. розчині NH4OH, якщо Кд = 1,77.10-5.
11. Ізотонічний коефіцієнт розчину 178,5 г KВr в 900 г H2O дорівнює 1,7. Визначити тиск водяної пари над цим розчином при 50 °С , якщо тиск пари води при 50 °С дорівнює 12334 Па.
Дата добавления: 2015-09-18; просмотров: 1238;
