Робота № 10/3. Визначення чисел переносу іонів у розчинах електролітів
Мета роботи. Визначити числа переносу іонів Н+ і SO42- у розчині сірчаної кислоти.
Методика роботи. При проходженні через розчин електроліту сталого електричного струму на катоді відбувається відновлення, на аноді - окиснення. Цей процес називається електролізом. При електролізі з інертними електродами в розчині Н2SО4 відбуваються такі електрохімічні процеси:
на катоді -  ,
,
на аноді -  .
.
Згідно з законом Фарадея (1) кількість речовини, що відновилась або окиснилась, n (молів) є пропорційною загальній кількості електрики еF, що пройшла через розчин електроліту, і електрохімічному еквіваленту цієї речовини а. Для перетворення 1 г-екв речовини потрібно  (число Фарадея).
(число Фарадея).
 . (1)
. (1)
де m - маса речовини; I - сила струму; t - час.
При електролізі іони переносять електричні заряди в розчині.
Перенос електрики в розчині сірчаної кислоти здійснюється іонами Н3О+ і SО42- (концентрація ОН- дуже мала).
Через кожен електрод проходять однакові кількості електричного струму, але кожен вид іонів переносить неоднакову частку електричного струму завдяки різним швидкостям руху іонів.
Кількість електричного струму, що переноситься катіонами та аніонами (j+, j-), є пропорційною їх заряду z, концентрації С (моль/см3) та швидкості спрямованого руху іонів (n±) у розчині, яка дорівнює  :
:
 ,
,
 . (2)
. (2)
Частку електричного струму, що переноситься катіонами або аніонами, називають числом переносу катіона або аніона (t+; t-)

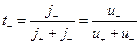 . (3)
. (3)
Таким чином, число переносу іона можна виразити відношенням абсолютної швидкості іона u± до суми абсолютних швидкостей обох іонів.
Добуток абсолютної швидкості іона на число Фарадея називається еквівалентною електропровідністю (рухливістю) іона:
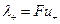 і
і  . (4)
. (4)
Відношення еквівалентних електропровідностей (рухливостей) іона та електроліта також дорівнює числу переносу:
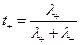 ;
;  . (5)
. (5)
Сума чисел переносу катіона та аніона дорівнює одиниці:
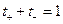 . (6)
. (6)
Під час електролізу внаслідок переміщення іонів під впливом поля і перетворень на електродах відбувається зміна концентрації електроліту в розчині біля обох електродів. Визначивши цю зміну, можна знайти числа переносу по відношенню зміни кількості електроліту біля аноду (або катоду) до загальної кількості розкладеного електроліту (n):
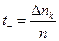 ,
,  , (7)
, (7)
де Dna - збільшення вмісту сірчаної кислоти в анодному просторі, а Dnk - зменшення вмісту сірчаної кислоти в катодному просторі.
Загальна кількість електрики, що пройшла через розчин, визначається за допомогою кулонометрів.
Мідний кулонометр (ваговий) складається з мідних електродів - пластинок, занурених в розчин електроліту такого складу:
CuSO4·5H2O – 150 г/л;
H2SO4 – 50 г/л;
C2H5OH – 50 г/л.
На межі поділу електрод - електроліт відбуваються процеси
 (на катоді);
(на катоді);
 (на аноді).
(на аноді).
Визначення кількості електрики, що пройшла через розчин, проводиться за рівнянням
 , (8)
, (8)
де m - маса міді, яка виділилась на катоді, г; 31,77 - хімічний еквівалент міді.
Порядок роботи.Схему пристрою для визначення чисел переносу іонів наведено на рисунку.
1. Перед початком досліду катод (мідну пластинку) чистять наждачною шкіркою, промивають дистильованою водою та ацетоном, висушують на повітрі і зважують на аналітичних терезах.
2. У мідний кулонометр наливають електроліт - розчин такого складу:
CuSO4·5H2O - 150 г/л; H2SO4 - 50 г/л; C2H5OH - 50 г/л.
3. Зважують пусті анодну і катодну посудини.
4. У посудини електролізера наливають 100 мл 0,05 н H2SO4.
5. Зважують посудини з розчином кислоти. Із різниці знаходять масу розчину в кожній з посудин.
6. Підключають електролізер до пристрою і пропускають струм силою 20 - 40 мА протягом 1-1,5 год.
7. Під час протікання електролізу визначають початкову концентрацію H2SO4. Для цього 10 мл розчину кислоти відтитровують 0,05 н розчином їдкого натру в присутності метилового оранжевого.
8. Після електролізу з катодної й анодної посудини відбирають піпеткою дві - три проби по 10 мл і титрують їх 0,05 н розчином їдкого натру.
9. Катод мідного кулонометра після промивання і просушування зважують на аналітичних терезах.

|
| Схема пристрою для визначення чисел переносу іонів: 1 - джерело постійного струму; 2 - реостат; 3 - електролізер для визначення чисел переносу іонів (а - анодна посудина, к - катодна посудина); 4 - міліамперметр; 5 - мідний кулонометр. |
10. Експериментальні дані заносять у таблицю:
| № проби | Об'єм титрованого розчину на 10 мл проби, см3 | |||
| до електролізу | після електролізу | |||
| анодний шар | катодний шар | середній шар | ||
| середне |
Дата добавления: 2015-09-11; просмотров: 803;
