Робота № 10/1. Визначення ступеня та константи дисоціації слабкого електроліту методом вимірювання електропровідності розчинів.
Мета роботи. Визначити питому та еквівалентну електропровідність розчинів слабкого електроліту, обчислити ступінь та константу дисоціації слабкого електроліту.
Методика роботи. Електроліти - це речовини, що дисоціюють у розчинах на іони. Іони під впливом електричного поля спрямовано рухаються і є переносниками зарядів.
Електропровідність - величина, зворотна опору
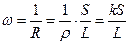 . (1)
. (1)
Величина k, зворотна питомому опору, називається питомою електропровідністю і являє собою електропровідність одиничного об'єму розчину (1 см3), що розміщений між паралельними електродами одиничної площі (1 см2), які знаходяться на відстані, що дорівнює 1 см.
Відношення питомої електропровідності до концентрації електроліту в 1см3 називають молярною електропровідністю m. Вона дорівнює електропровідності розчину, що містить 1 моль електроліту і розташований поміж паралельними електродами, що знаходяться на відстані 1 см один від одного і мають площу, яка дорівнює 1 см2.
 . (2)
. (2)
Часто користуютьсяеквівалентною електропровідністю:
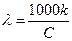 . (3)
. (3)
де С - концентрація, г-екв./л.
За відношенням l до її граничного значення l0 можна знайти ступінь дисоціації слабкого електроліту a
 . (4)
. (4)
Ступінь дисоціації слабких електролітів, що являє собою відношення кількості молекул, які розпалися на іони, до загальної кількості розчинених молекул, залежить від концентрації. У концентрованих розчинах а << 1.
За законом діючих мас та відповідно до рівняння реакції дисоціації одноосновної кислоти
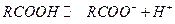 (5)
(5)
константа дисоціації має вигляд
 . (6)
. (6)
Нехай ступінь дисоціації дорівнює a. Якщо концентрація кислоти у розчині дорівнює С, то концентрації катіона і аніона дорівнюють aС, а концентрація недисоційованої частини (1-a)С. Тому
 . (7)
. (7)
Вимірювання електропровідності розчину електроліту грунтується на знаходженні величини його опору електричному струму методом компенсації, тобто порівнянням невідомого опору з відомим. Схему мосту змінного струму для вимірювання опору розчинів електролітів зображено на рисунку.
Загальний опір розчину є пропорційним відстані між електродами L і зворотно пропорційний їх площі S:
 , (8)
, (8)
де коефіцієнт пропорційності r називається питомим опором розчину.
Якщо в процесі вимірювань S і L залишаються сталими, тоді
 , (9)
, (9)
де К = L/S - стала електродів.
Порядок роботи.
1. Для визначення сталої електродів необхідно виміряти опір стандартних розчинів електролітів. Як правило, це 0,05 або 0,02 н розчин KCl. Значення питомої електропровідності розчинів KCl за різних температур наведено у довідниках.
У посудину для вимірювання електропровідності, промивши її дистильованою водою і два - три рази розчином KCl, наливають близько 20 мл розчину 0,02 н КС1. Рівень розчину KCl у посудині повинен перевищувати на 3 - 5 мм верхній край електродів. При всіх вимірюваннях об'єм рідини в посудині має бути однаковим, тому заповнювати посудину треба за допомогою піпетки. Через 10-15 хв після заповнення посудини починають вимірювання.
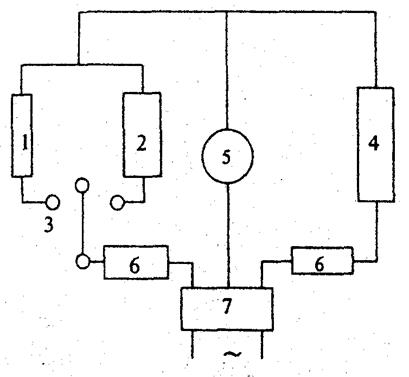
| Схема мосту змінного струму для вимірювання опору розчинів електролітів: 1 - магазин ємкостей; 2 - магазин опорів; 3 - перемикач; 4 - опір, який визначається; 5 - індикатор нуля (осцилограф); 6 - сталі та рівні опори плечей мосту; 7 - джерело живлення (генератор звукової частоти) |
Посудину підключають до схеми і визначають опір розчину електроліту. Сталу електродів K розраховують за рівнянням (9).
2. Після закінчення вимірювань для визначення сталої електродів розчин KCl виливають, посудину ретельно промивають і заповнюють розчином, що досліджується (1 н розчин оцтової кислоти). Посудину термостатують протягом 10 - 15 хв і вимірюють опір. Після цього з посудини піпеткою відбирають 20 мл розчину і додають 20 мл дистильованої води. Вода повинна мати ту ж саму температуру, що й розчин. Одна піпетка на 20 мл повинна використовуватися для розчину, а друга (також на 20 мл) - для доливання води.
Після розведення посудину обережно струшують для перемішування розчину і через 2 - 3 хв вимірюють опір розчину електроліту. Операції розведення повторюють п'ять - шість разів і для кожної концентрації електроліту вимірюють опір. Експериментальні дані заносять у таблицю:
| Концентрація розчину | Опір розчину | k | l | a | КДИС |
Визначивши опір для кожного значення концентрації розчину електроліту, що досліджується, розраховують питому та еквівалентну електропровідність за необмеженного розведення за рухливостями іонів за допомогою рівняння (11).
Визначають ступінь дисоціації та константу електролітичної дисоціації для кожної концентрації слабкого електроліту за рівняннями (4) і (7). Порівнюють розраховану константу дисоціації з літературними даними і розраховують похибки. Далі будують графіки в координатах k - С, l - С, a - С.
Література: [21, с. 180-194; 23, с. 269-284; 23, с. 235-241, 244-247; 24, с. 268-281; 25, с. 249-262; 26, с. 123].
Дата добавления: 2015-09-11; просмотров: 1104;
