Робота № 9/1. Дослідження швидкості реакції розкладу пероксиду водню
Мета роботи. Визначити константу швидкості реакції та дослідити вплив на неї температури й каталізаторів.
Методика роботи. Пероксид водню самочинно розкладається відповідно до рівняння:
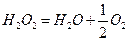 .
.
Реакція розкладу пероксиду є реакцією 1-го порядку. Швидкість реакції вивчають, вимірюючи об'єм кисню, який виділяється через різні проміжки часу від початку реакції (газометричний метод).
Порядок роботи. Схему пристрою, що використовується у роботі, наведено на рисунку.
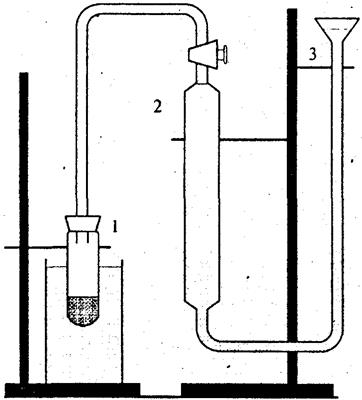
| Схема пристрою для визначення швидкості реакції розкладу пероксиду водню |
У пробірку наливають 5 мл розчину пероксиду водню і розміщують її у термостаті, налагодженому на задану температуру (за вказівкою викладача). Газову бюретку 2 заповнюють водою і встановлюють посудину для вирівнювання рівнів 3 так, щоб за відкритого верхнього крану бюретки рівень води в ній залишався на позначці "0". Щільно закривають пробірку з пероксидом корком, через який пропущено трубку, з'єднану з газовою бюреткою (кран при цьому з'єднує пробірку з атмосферою). Ставлять кран на бюретці у положення, за якого бюретка буде з'єднана з пробіркою, і одночасно включають секундомір (цей момент вважають початком реакції). Коли в бюретці збереться 2-3 мл газу, виконують перше вимірювання: встановлюють однакові рівні рідини у бюретці та зрівняльній посудині, записують рівень рідини у бюретці та час від початку реакції. Коли об'єм газу збільшиться ще на 2-3 мл, роблять наступне вимірювання; знову встановлюють однакові рівні в бюретці та посудині 3 і так далі до закінчення виділення газу. При роботі з каталізатором 5 мл розчину каталізатора розміщують у окремій пробірці у термостаті, витримують близько 10 хв, потім вливають у розчин пероксиду водню. Після цього виміри проводять так, як з розчином пероксиду без каталізатора. Яккаталізатори використовують розчини йодиду калію, хлоридів заліза та міді різних концентрацій. Результати вивчення швидкості реакціїї зводять у таблицю
| Час від початку реакції | Об'єм кисню V, мл | 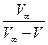
| 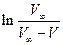
| k |
Константу швидкості реакції розраховують або за допомогою рівняння
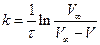 ,
,
або графічно, виходячи з кута нахилу прямої у координатах 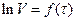 (константа швидкості реакції дорівнює тангенсу кута нахилу), де V∞ - кінцевий об'єм кисню, що виділився.
(константа швидкості реакції дорівнює тангенсу кута нахилу), де V∞ - кінцевий об'єм кисню, що виділився.
Література: [24].
Дата добавления: 2015-09-11; просмотров: 865;
