Робота № 9/2. Вивчення кінетики омилення складних ефірів у присутності іонів гідроксилу
Мета роботи. Визначити константу швидкості реакції омилення ефіру в присутності іонів ОН-.
Методика роботи. Як приклад реакції омилення складних ефірів можна розглянути реакцію:
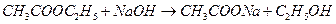 .
.
Цю реакцію проводять у водному розчині за надлишком лугу; проходить вона по 2-му порядку. Константу швидкості реакції обчислюють за рівнянням
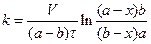 . (1)
. (1)
Кількість реагентів визначається титруванням однакових об'ємів проб (по 5 мл суміші) розчином кислоти (Ск).
Позначимо через V0, Vt, і Vµ об'єми кислоти (в мл), що йдуть на нейтралізацію лугу у пробі до початку реакції, у момент реакції та у кінці реакції. У такому випадку початкова кількість молекул лугу у пробі 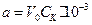 .
.
Оскільки на 1 моль ефіру при омиленні йде 1 моль лугу, то початкова кількість молей ефіру у пробі визначається різницею між початковою та кінцевою кількістю лугу:
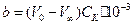 .
.
Тоді
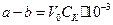 .
.
Кількість молів лугу у пробі у момент t дорівнює
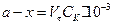 .
.
Тоді
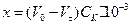 .
.
Кількість молів ефіру у пробі в момент t:
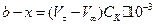 .
.
Отримуємо рівняння для розрахунку константи швидкості:
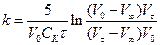 . (2)
. (2)
Перепишемо це рівняння у вигляді
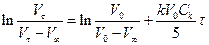 . (3)
. (3)
Оскільки початковий об'єм V0 визначити важко, будуємо лінійну залежність рівняння (3) у координатах 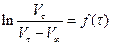 , та визначаємо
, та визначаємо 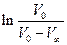 як відрізок на ординаті за
як відрізок на ординаті за 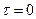 .
.
Порядок роботи.
1. Змішують 5 мл ефіру та 50 мл 0,0025 н NaOH та доводять до 100 мл. Момент змішування розчинів є моментом початку реакції.
2. Через кожні 3 - 5 хв беруть перші три проби по 5 мл та титрують НС1 у присутності фенолфталеїну до появи рожевого забарвлення.
3. Наступні проби беруть через 10 - 15 хв. За реакцією спостерігають 1,5 - 2 год, послідовно відбираючи для аналізу проби.
4. Результати вимірювань та розрахунків заносять у таблицю:
| Час | t, хв. | Vt, моль/л | (Vt-Vµ), моль/л | 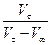
| 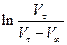
| k, л/(моль·хв) |
Література: [21, с. 217-242,253-256].
Дата добавления: 2015-09-11; просмотров: 684;
