Робота № 11/1. Визначення електрорушійних сил (ЕРС) гальванічних елементів і електродних потенціалів
Мета роботи. Вимірятиза допомогою компенсаційної схеми ЕРС гальванічних елементів, складених із цинкового, кадмієвого, свинцевого, мідного, хлорсрібного електродів. За ЕРС елементів, складених із хлорсрібного і металевого електродів, обчислити стандартний потенціал 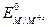 усіх досліджуваних електродів і порівняти їх з довідковими даними.
усіх досліджуваних електродів і порівняти їх з довідковими даними.
Використовуючи довідкові значення 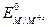 , обчислити ЕРС елементів, складених із двох різних металевих електродів
, обчислити ЕРС елементів, складених із двох різних металевих електродів  і порівняти з експериментально виміряними.
і порівняти з експериментально виміряними.
Методика роботи. Система, що складається з металу, зануреного в розчин добре розчинної його солі, є електрод 1-го роду. Стрибок потенціалу на межі поділу метал - розчин розраховується за рівнянням Нернста:
 , (1)
, (1)
де 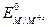 - стандартний електродний потенціал. Електрод, утворений із металевої пластини, вкритої погано розчинною сіллю цього металу і зануреної у водний розчин добре розчинної речовини, аніон якої є таким самим, як і у погано розчинної солі, є електродом 2-го роду. Електроди 2-го роду мають стабільне значення електродного потенціалу, і тому їх використовують як електроди порівняння. Такими є хлорсрібний, каломельний електроди. Нижче наведено потенціали каломельного електроду залежно від концентрації Cl-:
- стандартний електродний потенціал. Електрод, утворений із металевої пластини, вкритої погано розчинною сіллю цього металу і зануреної у водний розчин добре розчинної речовини, аніон якої є таким самим, як і у погано розчинної солі, є електродом 2-го роду. Електроди 2-го роду мають стабільне значення електродного потенціалу, і тому їх використовують як електроди порівняння. Такими є хлорсрібний, каломельний електроди. Нижче наведено потенціали каломельного електроду залежно від концентрації Cl-:
| Концентрація KCl, моль/л | 0,1 | 3,5 | нас. | |
| E, В за 297К | 0,3341 | 0,2812 | 0,2501 | 0,2415 |
Два різні електроди, з'єднані між собою, являють хімічне джерело струму, або гальванічний елемент. Наприклад, елемент, складений із цинкового і мідного електродів, зображується так:
(-) Zn |Zn2+ || Cu2+ |Cu (+) (2)
На цинковому електроді при замиканні елемента провідником 1-го роду відбувається такий процес: Zn – 2e = Zn2+ . Тому цей електрод має надлишок електронів, тобто його заряд - негативний.
На мідному електроді відбувається процес відновлення: Cu2+ + 2e = Cu. Склавши ці два процеси, одержимо загальну реакцію:
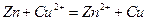 , (3)
, (3)
яка лежить в основі роботи даного гальванічного елемента.
Якщо дифузійний потенціал є близьким до нуля, то ЕРС елемента дорівнює:

 , (4)
, (4)
де Е0 - стандартна ЕРС гальванічного елемента, за допомогою якої обчислюють константу рівноваги реакції (3):
 . (5)
. (5)
Крім розглянутих гальванічних елементів (їх ще називають хімічними), є концентраційні, які складаються з однакових за своєю електрохімічною дією електродів, алез різними активностями компонентів металевої частини електроду або електроліту:
Zn | Zn2+ || Zn2+ | Zn, (6)
a1 > a2
Pt(H2) | H+ | (H2)Pt. (7)
f1 > f2
При замиканні зовнішнього ланцюга концентраційного елемента на його електродах відбуваються процеси,пов'язані із вирівнюванням активностей або фугітивностей речовин:

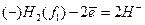

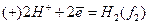
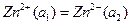

Зрозуміло, що елементи (6,7) будуть працювати доти, доки активності іонів Zn2+ або фугітивності водню не вирівнюються. ЕРС концентраційних елементів легко вивести, використовуючи рівняння Нернста (1):
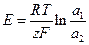 , або
, або 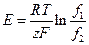 . (8)
. (8)
Часто в рівняннях (8) активності іонів і фугітивності газів замінюють концентраціями або тисками.
Найбільш точно ЕРС гальванічних елементів вимірюють компенсаційним методом, який дозволяє уникнути поляризації електродів та падіння ЕРС на внутрішньому опорі вимірювальних приладів, наприклад, вольтметра.
Найпростішу електричну схему, що використовується в компенсаційному методі, зображено на рис.1.
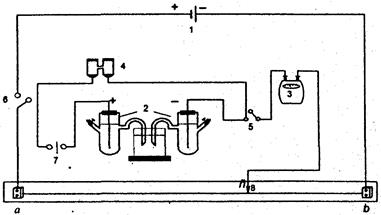
|
| Рис. 1. Схема пристрою для вимірювання ЕРС компенсаційним методом: 1 - акумулятор (А); 2 - гальванічний елемент, що досліджується; 3 - гальванометр (Г); 4 - нормальний елемент; 5,6 - вимикач (телеграфний ключ, ключі К1 та К2); 7 - перемикач; 8 - рухливий контакт (С) |
До кінців реохорда ab (тонкий однорідний дріт, натягнутий на лінійку) приєднують акумулятор А. У боковий ланцюг підключають послідовно досліджуваний елемент, чутливий гальванометр Г та ключі К1 і К2. При цьому позитивні полюси акумулятора і досліджуваного елемента підключають до одного кінця реохорда. Переміщуючи контакт С і замикаючи ключі К1 і К2 на короткий час, знаходять таке положення, щоб через гальванометр не протікав струм (точка компенсації). Струми в ланцюгах акумулятора і елемента є протилежно спрямованими, тому компенсація можлива за співвідношення:
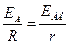 , (9)
, (9)
де ЕА і ЕДЕ - електрорушійні сили акумулятора і досліджуваного елемента.
Враховуючи, що 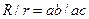 , рівняння (9) можна переписати:
, рівняння (9) можна переписати:
 , (10)
, (10)
Оскільки значення ЕА невідоме і може змінюватись з часом, для його визначення в боковий ланцюг замість елемента ДЕ слід підключити елемент з відомим і практично постійним значенням ЕРС. Для цього найчастіше використовують насичений нормальний елемент Вестона, ЕРС якого залежить від температури:
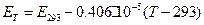 . (11)
. (11)
Очевидно, що температурний коефіцієнт ЕРС є малим.
Елемент Вестона являє собою Н-подібну скляну посудину (рис. 2).
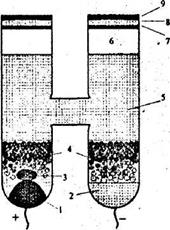
| Рис. 2. Схема нормального елемента Вестона: 1 - ртуть; 2 - амальгама кадмію; 3 - суміш сульфатів кадмію і ртуті; 4 - кристали сульфату кадмію; 5 - насичений розчин сульфату кадмію; 6 - бульбашка повітря; 7 - парафін; 8 - корок; 9 - менделєєвська замазка |
У дно кожного з колін посудини впаяно дроти, що слугують полюсами елемента. В одне коліно заливають ртуть, в друге - рідку амальгаму кадмію (12,5%) за температури 70°С. Рівні ртуті та амальгами ртуті становлять близько 0,5 см. На поверхні ртуті розміщують пасту, одержану шляхом розтирання ртуті з твердими Нg2SО4 та СdSО4·8/3Н2О у присутності дуже невеликої кількості насиченого розчину СdSО4. Потім в обидва коліна вносять дрібні кристали СdSО4·8/3Н2О (приблизно до половини посудини) і заливають насиченим розчиномСdSО4.
Зверхуобидва коліназаливають або закривають парафінованими корками. Схемацього елементу така:
(-) Pt, Hg-Cd | CdSO4 | | Hg2SO4 | Hg, Pt (+). (12)
Запишемо рівняння реакцій, якіпротікають на електродах:

 (13)
(13)
Сумарне рівняння струмоутворюючої реакції в елементі:
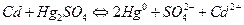 . (14)
. (14)
ЕРС нормального елемента дорівнює 1,083 В.
Дата добавления: 2015-09-11; просмотров: 1604;
