Робота № 11/3. Визначення стандартного окисно-відновного потенціалу
Мета роботи. Визначити окисно-відновний потенціал системи Fe2+,Fe3+/Pt за різних концентрацій іонів в розчині, обчислити стандартний окисно-відновний потенціал.
Методика роботи. У роботі вимірюється ЕРС гальванічного елемента
Pt, Ag | AgCl, KCl | | Fe2+, Fe3+ | Pt. (1)
З одержаних величин ЕРС визначають потенціал окисно-відновного електроду в умовах досліду і обчислюють стандартний окисно-відновний потенціал і константу рівноваги електродної реакції.
Порядок роботи. Для дослідів необхідно приготувати слабко підкислені 0,05 н розчини сульфатів або хлоридів заліза різного ступеня окиснення (II і III) і титруванням визначити концентрації вихідних розчинів. Методику титрування описано нижче. З цих розчинів готують суміші з різним співвідношенням окисненої та відновленої форм іонів заліза, наприклад:
FeCl2, мл 10 20 30 40 90
FeCl3, мл 40 30 20 30 10
Для приготування окисно-відновного електроду в скляну посудину наливають одну з підготовлених сумішей і занурюють в неї платиновий електрод. Платину попередньо очищають у хромовій суміші і промивають дистильованою водою.
Далі збирають гальванічний елемент (1) і компенсаційним методом вимірюють його ЕРС. Для кожної приготовленої суміші солей заліза вимірювання проводять декілька разів через проміжки 5-10 хв до встановлення постійних значень.
Після закінчення вимірювань досліджуваний розчин аналізують на вміст іонів Fe2+ і Fe3+. Вміст заліза II визначають титруванням 10 мл розчину 0,1 н розчином KMnO4 (V1) у присутності реактиву Циммермана-Рейнгарда (MnSO4, H2SO4, Н3РО4). Для визначення вмісту заліза III до 10 мл розчину додають 1,5 - 2 г сухого йодиду калію і титрують 0,1 н розчином Na2S2O3 у присутності крохмалю. Титрування повторюють два-три рази. Аналогічні вимірювання і аналізи проводять з іншими досліджуваними розчинами[3].
Оскільки окисно-відновний потенціал системи Fe3+,Fe2+ є більш додатним, ніж потенціал каломельного електроду, то виміряна ЕРС (Е) дорівнює:
 . (2)
. (2)
Виходячи з цього рівняння, обчислюють  для кожного з досліджених елементів. Далі за значеннями
для кожного з досліджених елементів. Далі за значеннями  розраховують стандартний електродний потенціал
розраховують стандартний електродний потенціал  і константу рівноваги електродної реакції за рівнянням:
і константу рівноваги електродної реакції за рівнянням:
 ; (3)
; (3)
 . (4)
. (4)
Якщо наближено вважати коефіцієнти активності іонів Fe2+ і Fe3+ в досліджуваних розчинах рівними одиниці, співвідношення активностей в (3) можна замінити співвідношенням концентрацій:
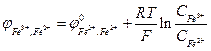 . (5)
. (5)
За однакової концентрації розчинів КМnО4 і Na2S2O3 рівняння (4) має вигляд:
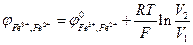 . (6)
. (6)
Для більш точних розрахунків необхідно враховувати коефіцієнти активності іонів, які можна обчислити за іонною силою розчинів, використовуючи рівняння теорії сильних електролітів Дебая-Хюккеля.
Література: [21, с. 128-150; 22, с. 286-300, 305, 306; 23, с. 262-277,290-299; 24, с. 288-302, 308, 309; 25 283-298; 26, с. 89, 143]
Дата добавления: 2015-09-11; просмотров: 907;
