Робота № 11/4. Визначення коефіцієнта активності електроліту методом вимірювання ЕРС
Мета роботи. Визначити середній коефіцієнт активності хлористого водню в розчинах соляної кислоти різної концентрації.
Методика роботи. Активність іона - це "ефективна" концентрація, яку використовують замість справжньої концентрації в термодинамічних рівняннях, виведених для ідеальних розчинів. Коефіцієнт активності іона - це відношення активності іона до його концентрації
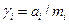 . (1)
. (1)
Виміряти активність (або коефіцієнт активності) окремого виду іонів неможливо, тому на практиці використовують середні коефіцієнти активності γ±, які виражаються через активності окремих іонів рівнянням
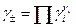 , (2)
, (2)
де νi - кількість іонів даного виду в молекулі електроліту. Щодо хлориду водню вказані рівняння мають вигляд:
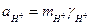 ;
;
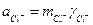 ;
;
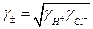 ; (3)
; (3)
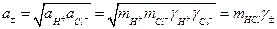 .
.
Найточніше середній коефіцієнт активності вимірюють методом ЕРС. Оскільки електрорушійна сила являє собою різницю двох електродних потенціалів, то при вимірюванні γ± треба один із електродів вибрати таким, щоб він був оберненим відносно аніона електроліту, активність якого вимірюється, а другий - оберненим відносно катіона цього електроліту. Треба також, щоб у побудованого з вибраних електродів гальванічного елемента не було переносу іонів, тобто щоб в ньому не виникали дифузійні потенціали.
При вимірюванні γ± хлориду водню один із електродів повинен бути оберненим відносно іона хлору (хлорсрібний, каломельний), другий - іонів водню (водневий, хінгідронний, скляний). Залежність потенціалів цих електродів від активності іонів виражається рівняннями Нернста:
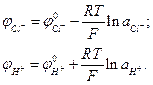 (4)
(4)
Електрорушійна сила гальванічного елемента, побудованого з водневого електроду і хлорсрібного або каломельного (з урахуванням (3)) дорівнює:
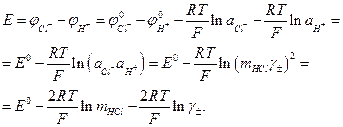 (5)
(5)
Абсолютні значення активностей залежать від вибору стандартного стану розчиненої речовини. Для електролітів стандартний стан обирається відповідно до вимоги, щоб активність і концентрація збігалися в безмежно розведеному розчині. У цьому разі 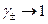 , якщо
, якщо 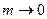 . Тоді з рівняння (5) випливає:
. Тоді з рівняння (5) випливає:
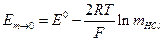 . (6)
. (6)
Порядок роботи. Готують розчини соляної кислоти концентрації 0,1; 0,05; 0,01; 0,005; 0,001 і 0,0005 моль/л. По черзі, використовуючи кожен із цих розчинів, складають гальванічні елементи із електродів, обернених відносно іонів хлору і водню, наприклад: (Pt) H2 | HCl | AgCl, Ag.
ЕРС елемента вимірюють за допомогою потенціометра, з одержаних результатів розраховують величини Е + (2RT/F) ln m. Будують залежність в координатах [Е + (2RТ/F)ln m] - m (рис. 1). Згідно з рівнянням (6) за 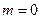
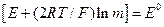 .
.
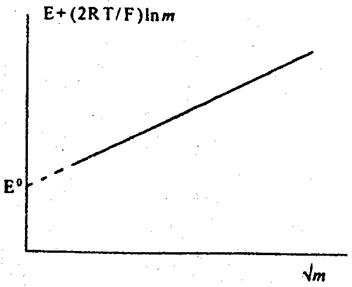
| Рис. 1. Графічна залежність, що ілюструє визначення величини Е° |
Отже, екстраполяцією на 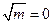 знаходять Е°. Після цього, використовуючи рівняння (5), розраховують середній коефіцієнт активності і середню активність:
знаходять Е°. Після цього, використовуючи рівняння (5), розраховують середній коефіцієнт активності і середню активність:
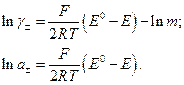 (7)
(7)
У хінгідронного електрода потенціал є більш додатним, ніж у хлорсрібного або каломельного, тому, коли замість водневого електроду використовують хінгідронний, електрорушійна сила виражається рівняннями:
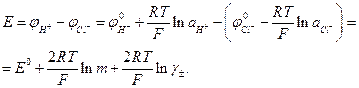 (8)
(8)
Ці рівняння відрізняються від рівняння (5) знаками перед доданками, що містять т і γ±. Тому при обробці результатів експерименту слід розраховувати величини Е - (2RТ/F) ln m і будувати графік, показаний на рис. 2.
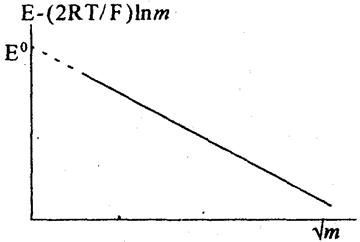
| Рис. 2. Графічна залежність, що ілюструє визначення величини E0 |
Як і у випадку з водневим електродом, E° знаходять екстраполяцією на  , а середню активність і коефіцієнт активності (відповідно до рівняння (8)) обчислюють за формулами
, а середню активність і коефіцієнт активності (відповідно до рівняння (8)) обчислюють за формулами
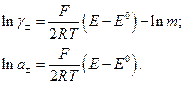 (9)
(9)
Результати вимірювань заносять у таблицю:
| mHCl | E | E ± (2RT/F) ln m | γ± | a± |
Література: [21, с. 128-147, 171-173; 23, с. 262-277, 293-299, 301-303; 24, с. 298-302, 309-312; 25, с. 283-297, 314; 26, с. 130, 133, 135].
Дата добавления: 2015-09-11; просмотров: 1214;
