Гидролиз солей
Гидролиз - реакция ионного обмена между различными веществами и водой. Процессу гидролиза подвергаются соли, углеводы, белки, эфиры, жиры и т.д.
Гидролиз соли - это взаимодействие между ионами соли и ионами воды, приводящее к образованию слабого электролита.
Гидролиз солей обусловлен взаимной электролитической диссоциацией солей и воды, а также образующихся в результате гидролиза кислот, оснований и солей. Гидролиз протекает с образованием малодиссоциированных, летучих или малорастворимых веществ. В процессе гидролиза один или оба иона незначительно диссоциирующей воды связываются ионами подвергающейся гидролизу соли, вследствие чего все новые и новые молекулы воды вовлекаются в реакцию. Гидролизу подвергаются соли, образованные:
- слабым основанием и сильной кислотой (например, 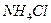 ,
, 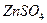 );
);
- сильным основанием и слабой кислотой (например, 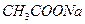 ,
, 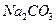 );
);
- слабым основанием и слабой кислотой (например, 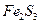 ;
; 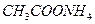 ).
).
Рассмотрим три случая гидролиза:
1. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону.
Например, соль 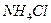 образована слабым основанием
образована слабым основанием 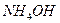 и сильной кислотой
и сильной кислотой 
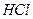 .
.
В водном растворе соль диссоциирует на катионы 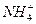 и анионы
и анионы 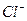 :
:
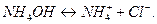
Гидролиз идет по иону слабого электролита, то есть по катиону 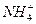 :
:
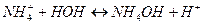 .
.
Это сокращенное молекулярно-ионное уравнение данного процесса. Для составления молекулярного уравнения катионы 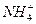 и высвобождающийся ион водорода нужно объединить с анионом сильной кислоты (
и высвобождающийся ион водорода нужно объединить с анионом сильной кислоты ( 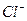 ):
):
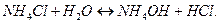
Накопление ионов 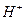 приводит к тому, что реакция среды становится кислой,
приводит к тому, что реакция среды становится кислой, 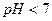 .
.
Если соль образована сильной кислотой и слабым многокислотным основанием, гидролиз протекает ступенчато. Например,соль 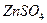 образована слабым двухкислотным основанием
образована слабым двухкислотным основанием 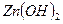 и сильной кислотой
и сильной кислотой 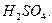 В водном растворе эта соль диссоциирует:
В водном растворе эта соль диссоциирует:
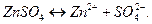
Возможны две ступени гидролиза:
1 ступень: 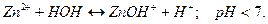
Для составления молекулярного уравнения, образовавшиеся положительно заряженные ионы ( 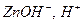 ) нужно объединить с анионами сильной кислоты (
) нужно объединить с анионами сильной кислоты ( 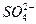 ) и составить формулы соединений с учетом зарядов ионов:
) и составить формулы соединений с учетом зарядов ионов:
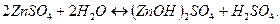
2 ступень: 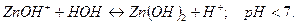
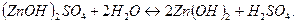
Практически (преимущественно) гидролиз идет только по первой ступени.
2. Соли, образованные сильным основанием и слабой кислотой, гидролизуются по аниону. Например,соль 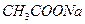 образована сильным основанием
образована сильным основанием 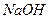 и слабой кислотой
и слабой кислотой 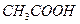 . Ее диссоциация:
. Ее диссоциация:
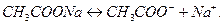
Гидролиз идет по аниону:
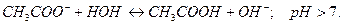
Для составления молекулярного уравнения высвобождающийся гидроксид ион ( 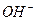 ) и ион
) и ион 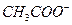 нужно объединить с катионом сильного основания (
нужно объединить с катионом сильного основания ( 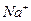 ):
):
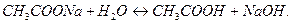
Накапливание ионов 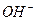 создает щелочную реакцию среды (
создает щелочную реакцию среды ( 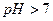 ).
).
Гидролиз солей слабых многоосновных кислот протекает ступенчато. Например, соль 
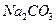 образована сильным основанием
образована сильным основанием 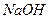 и слабой двухосновной кислотой
и слабой двухосновной кислотой 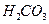 . Ее диссоциация:
. Ее диссоциация:
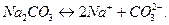
Возможны две ступени гидролиза:
1 ступень: 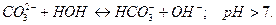
Чтобы составить молекулярное уравнение нужно все отрицательно заряженные ионы объединить с катионами сильного основания ( 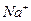 ) и составить формулы соединений:
) и составить формулы соединений:
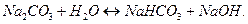
2 ступень: 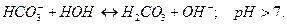
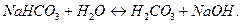
Практически (преимущественно) гидролиз идет только по первой ступени
3. Соли, образованные слабым основанием и слабой кислотой, гидролизуются и по катиону, и по аниону. Например,соль 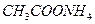 образована слабым основанием
образована слабым основанием 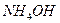 и слабой кислотой
и слабой кислотой 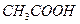 . Ее диссоциация:
. Ее диссоциация:
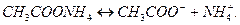
Гидролизуя катион и анион, получим:
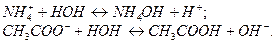
Суммируя процессы гидролиза по катиону и по аниону и учитывая, что 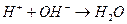 , получим суммарное уравнение гидролиза по катиону и по аниону:
, получим суммарное уравнение гидролиза по катиону и по аниону:
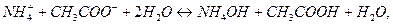 или
или
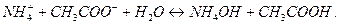
Реакция среды в этом случае близка к нейтральной, так как не происходит заметного накопления избытка ионов 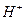 или
или 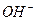 (
( 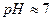 ).
).
Если кислота и основание, образующие соль, не только слабые электролиты, но и малорастворимы или неустойчивы, то гидролиз сопровождается полным разложением соли:
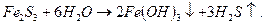
Полному гидролизу в водных растворах подвергаются также нитриды, фосфиды, карбиды и силициды металлов:
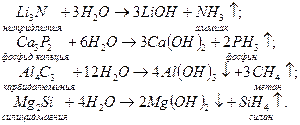
Соли, образованные сильным основанием и сильной кислотой, например, 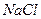 , гидролизу не подвергаются, среда остается нейтральной (
, гидролизу не подвергаются, среда остается нейтральной ( 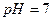 ).
).
Дата добавления: 2015-10-19; просмотров: 1372;
