Будова білкової молекули
Первинна структура.Під первинною будовою білкової молекули розуміють порядок чергування амінокислот у поліпептидному ланцюзі і місцеположення дисульфідних зв’язків. Основний зв’язок первинної структури – пептидний.
Вторинна структура – це впорядковане просторове розміщення окремих ділянок поліпетидного ланцюга без урахування типу та конформації бокових радикалів амінокислот. Вона утворюється за рахунок закриття водневих зв’язків між пептидними групами. Вторинна структура представлена такими регуляторними структурами як a-спіраль, b-структура, b-вигин.
Зверхвторинна структура –просторова будова ансамблів, утворених регуляторними структурами вторинної структури:a-спіраллю, b-структурою, b-вигином.
Третинна структура - це впорядковане просторове розміщення окремих ділянок поліпетидного ланцюга з урахуванням типу та конформації бокових радикалів амінокислот.
Четвертинна структура – спосіб взаємного розміщення у просторі окремих поліпептидних ланцюгів у молекулі, враховуючи характер зв’язків між ними. Така структура характерна для білків, молекула якої має два і більше поліпептидних ланцюги. Ці білки називаються олігомерними.
Реакції осадження білків. Білки можна виділити з розчинів у вигляді осадів. Існує багато різних способів осадження білків. Залежно від осаджувача ці реакції поділяють на дві групи. До першої групи належать оборотні реакції осадження. Білки цієї групи, випадаючи в осад, глибоких змін не зазнають і можуть розчинятися в первинному розчиннику, здебільшого у воді. Молекули білків при цьому зберігають свої первинні (нативні) властивості і не зазнають денатурації.
Другу групу становлять необоротні реакції осадження. У цьому разі молекули білків зазнають глибоких змін і не можуть знову розчинятися в первинному розчиннику, тобто білки зазнають денатурації.
Денатурацією називається така зміна білка, при якій він втрачає свої природні біологічні й фізико-хімічні властивості, стає менш гідрофільним і втрачає здатність розчинятися у воді.
Осадження білків концентрованими розчинами нейтральних солей називається висолюванням. Більшість реакцій висолювання, а також реакції зі спиртом, ацетоном та іншими реактивами є оборотними. До необоротних реакцій осадження білків належать: осадження білків солями важких металів, алкалоїдними реактивами, кислотами, осадження нагріванням.
Молекули білків мають значну стійкість у воді. Це пояснюється тим, що білки є гідрофільними колоїдами. Водна оболонка утворює захисний шар для білкових частинок, не дає можливості їм збільшуватися і коагулювати.
Важливим фактором стійкості білкових розчинів є однойменний електричний заряд частинок, що сприяє їх відштовхуванню.
Якщо до розчинів білків додавати солі лужних і лужноземельних металів, то їх іони адсорбуються молекулами білків, знімають з них електричні заряди і роблять молекули білків електронейтральними. Надалі колоїдні частинки укрупнюються, що зумовлює утворення осаду. Реакцію висолювання зумовлює дегідратація молекул білка з одночасною нейтралізацією електричних зарядів. Процес висолювання білків є оборотною реакцією, оскільки осад білка може знову розчинятися розведенням його водою або зменшенням концентрації солей діалізом. Для висолювання різних білків потрібна різна концентрація тих самих солей. Це дає змогу дістати різні білкові фракції.
Реакції осадження білків мають важливе значення в практиці, їх застосовують для вивчення властивостей білків, виділення білків з розчинів, установлення наявності білків у сечі (при нефритах, серцевій декомпенсації).
Методом висолювання білків користуються для добування білків у кристалічному вигляді, виділення препаратів ферментів і гормонів.
Осадження білків при нагріванні та чутливість якісних реакцій на білки.Майже всі білки при нагріванні зсідаються, отже білки можна виявити, прокип'ятивши їх в нейтральному або слабо-кислому середовищі. Різні білки зсідаються при різних температурах. Одні починають зсідатися вже при температурі 50—55° С, інші витримують навіть нетривале кип'ятіння.
Коагуляція білків найвища в ізоелектричній точці. Ізоелектрична точка для більшості білків лежить в межі слабкокислої реакції (рН близько 5,0). Виняток становлять гістони й протаміни, що мають ізоелектричну точку в лужному середовищі (рН близько 8,0). Лужний характер протамінів і гістонів зумовлено надміром диаміномонокарбонових кислот, що входять до складу цих білків (лізин, аргінін, гістидин).
Гідроліз білків.Гідролізом називається процес розпаду речовини на простіші складові частини, пов'язаний з приєднанням води в місці розриву зв'язків. Незначний гідроліз білків можна викликати слабким нагріванням їх з водою. Повного гідролізу молекул білків досягають тривалим кип'ятінням білків з мінеральними кислотами або лугами, а також діючи ферментами.
ТЕМА 3. Ферменти.
| Термінологічний мінімум: | |
| 1. Апофермент; 2. Холофермент; 3. Кофермент (кофактор); 4. Активний центр; 5. Каталітична зона; 6. Зона зв’язування; | 7. Проферменти (зимогени); 8. Активатори; 9. Інгібітори; 10. Специфічність; 11. Термолабільність; |
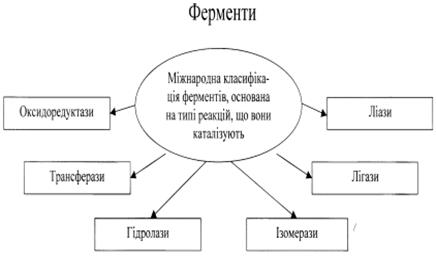
Ферментами (ензимами)називають речовини білкового походження, що містяться в клітинах і тканинах живих організмів і відіграють роль біологічних каталізаторів. Переважна більшість хімічних реакцій в організмі (наприклад, окислення — відновлення, тканинне дихання, травлення тощо) відбувається в тканинах і біологічних рідинах під дією ферментів. Ферменти відіграють величезну роль в обміні речовин між зовнішнім середовищем та організмом. Від кількості та активності ферментів залежить життєдіяльність організму. Вивчення ферментів має надзвичайно велике значення для розуміння хімічних процесів, що відбуваються в живому організмі, і для дальшого розвитку біохімії. Залежно від будови ферменти поділяють на прості й складні.

Білкова частина двокомпонентних молекул називається апоферментом, а молекула в цілому – холоферментом. Небілковий компонент ферменту – кофермент (кофактор).
Активним центром ферменту називається та область ферментативної молекули, в якій проходить зв’язування та перетворення субстрату. В активному центрі функціонально виділяють каталітичну зону та зону зв’язування.
Багато ферментів виділяються тканинами в неактивному стані у вигляді проферментів, або зимогенів. Ці ферменти активізуються спеціальними активаторами — кіназами. Так, І. П. Павлов довів, що неактивний фермент пепсиноген під дією соляної кислоти переходить в активний пепсин. Ліпазу панкреатичного соку активізують жовчні кислоти.
Найважливіші властивості ферментів — оборотність дії, термолабільність, залежність дії від концентрації водневих іонів, висока каталітична активність і специфічність.
Дія ферментів значною мірою залежить від активаторів та інгібіторів. Активатори— це речовини, які прискорюють дію ферменту, інгібітори — ті, що пригнічують її.
Дія ферментів докорінно відрізняється від дії неорганічних каталізаторів.
Дата добавления: 2015-11-18; просмотров: 4290;
