Будова атомів хімічних елементів.
У 1879 р. Крукс відкрив катодні промені (ідентифіковані як поток електронів).
У 1886 р. Гольдштейн відкрив каналові промені (ідентифіковані як поток іонів з позитивним зарядом, кратним заряду електрона).
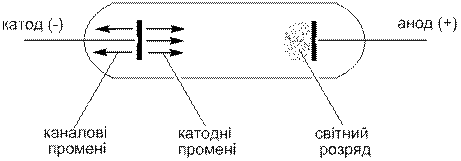
До двох електродів, впаяних в скляну трубку з розрідженим газом, прикладають високу напругу (до 10000 В). Це спричинює руйнування молекул газу, що супроводжується утворенням ē та позитивно заряджених іонів, а також виникненням світного розряду.
Електрони прямують до анода і утворюють катодні промені, а позитивно заряджені іони – до катода і утворюють каналові промені. Дослідження каналових променів показало, що вони складаються з важких заряджених частинок, подібних за масою до вихідних атомів, а їх природа залежить від природи газу. Катодні промені однакові для всіх газів.
У 1895 р. Рентген відкрив Х-промені (рентгенівські промені), які виявилися електромагнітним випромінюванням з дуже короткою довжиною хвилі – 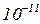 м.
м.
Ці відкриття підтверджували, що атоми містять позитивно і негативно заряджені частинки, зв’язані між собою особливими внутрішньоатомними силами.
У 1897 р. Томсон відкрив електрон і за відхиленням пучка катодних променів у електричному та магнітному полях знайшов відношення заряду електрона до його маси. Після визначення у 1909 р. Маллікеном заряду електрона було обчислено масу спокою електрона 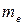 , що становить
, що становить 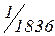 маси атома найлегшого елемента – гідрогену.
маси атома найлегшого елемента – гідрогену.
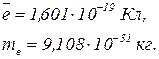
У 1896 р. Бекерель відкрив явище природного радіоактивного розпаду і розділив випромінювання, яке супроводжувало цей процес, на три складові:
ü 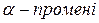 відхилялися до негативно зарядженого полюса зовнішнього електричного поля, мали невелику проникну здатність (ядра атомів гелію
відхилялися до негативно зарядженого полюса зовнішнього електричного поля, мали невелику проникну здатність (ядра атомів гелію 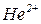 );
);
ü 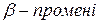 відхилялися до позитивно зарядженого полюса зовнішнього електричного поля (поток електронів з високою енергією);
відхилялися до позитивно зарядженого полюса зовнішнього електричного поля (поток електронів з високою енергією);
ü 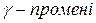 були ідентифіковані як короткохвильове електромагнітне випромінювання.
були ідентифіковані як короткохвильове електромагнітне випромінювання.
Модель атома Томсона (кавуноподібна):
атом – згусток позитивно зарядженої матерії, в яку вкраплено негативно заряджені електрони, що компенсують позитивний заряд.
Модель атома Резерфорда (планетарна):
у центрі знаходиться дуже мале за розмірами ядро, а електрони рухаються навколо нього по колових орбітах. Практично вся маса зосереджена в малому об’ємі ядра. Число електронів відповідає зарядові ядра. В цілому атом електронейтрален.
Дата добавления: 2015-09-02; просмотров: 1172;
