ТЕМА 2. Білки: будова, властивості, роль в організмі.
| Термінологічний мінімум: | |
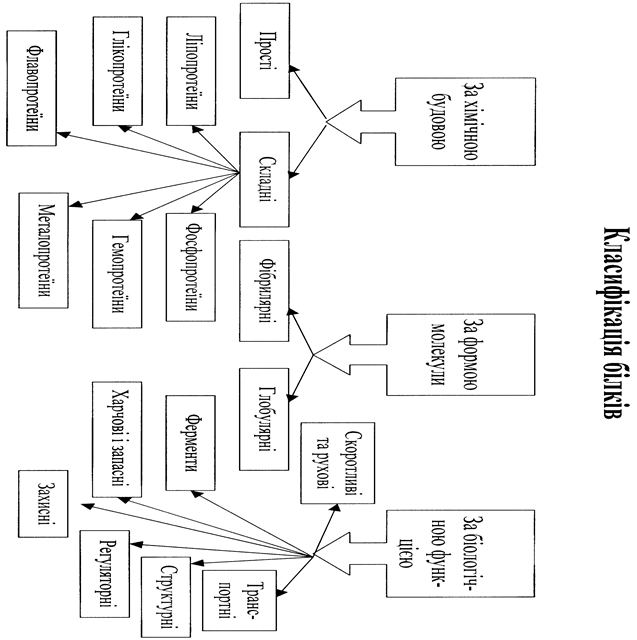
| 1. Прості протеїни; 2. Складні протеїди; 3. Простетична група; 4. Ізоелектрична точка білка; 5. Денатурація; 6. Висолювання; 7. Амінокислота; 8. Циклічні амінокислоти; 9. Ациклічні амінокислоти; 10. Первинна структура білка; 11. Пептидний зв'язок; 12. Вторинна структура білка; 13. a-спіраль; 14. b-структура; | 15. b-вигин; 16. Гідрофобні взаємодії; 17. Третинна структура білка; 18. Четвертинна структура білка; 19. Олігомерні білки; 20. Глобулярні білки; 21. Фібриллярні білки; 22. Ліпопротеїни; 23. Глікопротеїни; 24. Флавопротеїни; 25. Фосфопротеїни; 26. Гемопротеїни; 27. Маталопротеїни; 28. Гідроліз білків; |
Для життєдіяльності організму необхідний цілий ряд як органічних, так і мінеральних речовин, проте вирішальну роль у житті організму відіграють білки. Білкиналежать до високомолекулярних азотовмісних органічних речовин, які при гідролізі утворюють амінокислоти. Усі білки поділяють на дві групи: прості (протеїни) і складні (протеїди). Прості білки складаються тільки з білкової частини, а складні містять ще й небілкову частину (простетичну групу). Прикладом простетичних груп є вуглеводи, нуклеїнові кислоти, ліпіди та ін.
| Функції білків: | |
| 1. Структурна функція; 2. Каталітична функція; 3. Рухова функція; 4. Транспортна функція; 5. Захисна функція; | 6. Гормональна функція; 7. Запасна функція; 8. Опорна функція; 9. Рецепторна функція; 10. Харчове значення. |
У живому організмі білки перебувають у колоїдному стані, тому для них характерні деякі властивості колоїдних розчинів. Молекула білка складається із залишків амінокислот, сполучених між собою пептидними зв'язками.
Різноманітність тваринних і рослинних організмів у природі пояснюється різноманітністю білків, що в свою чергу залежить від особливостей поєднання амінокислот, а також від порядку їх сполучення, якісного й кількісного складу. До складу білків входять аміногрупи (—NН2) і карбоксильні групи (-СООН). Аміногрупи є носіями основних властивостей речовин, а карбоксильні групи — кислотних, отже білки можуть поводитися як основи і як кислоти, тобто проявляти амфотерні властивості. У лужному розчині білки дисоціюють як кислоти. У цьому разі їх молекули заряджаються негативно, і в електричному полі рухаються до анода. У кислотному середовищі білки заряджаються позитивно, дисоціюють як луги і, коли через розчин проходить електричний струм, рухаються до катода. Можливі випадки, коли в молекулах білка (при певній концентрації водневих іонів у розчині) утворюється однакова кількість позитивних і негативних зарядів. Таке значення рН, при якому частинки білка не пересуваються в електричному полі ні до аноду, ні до катоду, й сумарний електричний заряд дорівнює нулю, називається ізоелектричною точкою білка.
При кип'ятінні з мінеральними кислотами або лугами, а також під дією специфічних ферментів (пепсин, трипсин, хімозин тощо) білки гідролізуються, утворюючи цілий ряд проміжних продуктів (пептони, поліпептиди), а при повному гідролізі розпадаються на амінокислоти.
Амінокислоти – це похідні карбонових кислот, в яких один з атомів водню вуглецевого ланцюга заміщений на групу NH2.
NH2
|
R – C - COOH
|
H
У залежності від характеру бокових ланцюгів амінокислоти розділяють на: ациклічні та циклічні (гомо- та гетероциклічні).
По кількості амінних та карбоксильних груп амінокислоти розділяють на:
1. Моноаміномонокарбонові (гліцин, аланін, валін та ін.)
2. Диаміномонокарбонові (лізин, аргінін та ін.)
3. Моноамінодикарбонові (аспарагінова та глутамінова кислоти)
4. Диамінодикарбонові (цистин).
Дата добавления: 2015-11-18; просмотров: 1337;
