В растворах, проводящих электрический ток, происходит самопроизвольный распад (электролитическая диссоциация) молекул на ионы.
Было установлено, что диссоциации подвергаются вещества с ионной или полярной связями при растворении их в растворителях с большой диэлектрической проницаемостью. К таким растворителям в первую очередь относится вода.
Механизм электролитической диссоциации хлорида калия в воде приведен на рисунке 4.1. Из данной схемы видно, что продукты диссоциации электролита (ионы) в результате электростатического взаимодействия с растворителем образуют сольваты или в случае воды – гидраты.
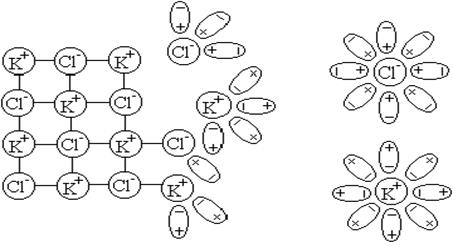
Рисунок 4.1 – Схема растворения и диссоциации хлорида калия.
Электролитическая диссоциация – это распад вещества на ионы под действием полярных молекул растворителя.
По способности распадаться на ионы электролиты делятся на сильные и слабые. Для описания ряда свойств сильных и слабых электролитов применяются различные математические зависимости.
Сильные электролиты диссоциируют необратимо и практически полностью. В уравнении диссоциации ставят знак «®» (односторонний процесс). Примеры диссоциации основных классов неорганических соединений:
Ca(OH)2 ® Ca2+ + 2OH–,
H2SO4 ® 2H+ + SO42–,
Cr2(SO4)3 ® 2Cr3+ + 3SO42–.
Концентрации ионов в растворах сильных электролитов можно рассчитывать по уравнениям их диссоциации.
В соответствии с положением в периодической таблице элемента, образующего соответствующий электролит, к сильным электролитам относятся:
1) Основания – I-группа, II-группа начиная с Са(ОН)2 и III-я ТlОН;
2) Кислоты – V-группа НNО3, VI-группа Н2SО4 и Н2SеО4, VII-я НСl, НСlО4, НСlО3 и соответствующие кислоты для брома и йода;
3) Соли – все хорошо растворимые.
Остальные электролиты, за немногим исключениям, относятся к слабым.
Слабые электролиты диссоциируют обратимо и ступенчато.
Для характеристики диссоциации слабых электролитов применяется степень диссоциации (α) и константа диссоциации (Кд).
Степень диссоциации (α) показывает, какая часть электролита распалась на ионы.
Данные равновесия подчиняются закону действующих масс и количественно выражаются через Кд. Например, для диссоциации водного раствора аммиака:
NH4ОH«NH4+ + OH– , Kд = 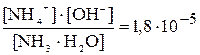 .
.
Константа диссоциации количественно характеризует силу электролита, чем меньше значение константы диссоциации, тем слабее электролит.
В случае многозарядных слабых электролитов диссоциация протекает ступенчато. Например, для ортофосфорной кислоты:
I-ступень – H3PO4 « H+ + H2PO4– Кд1 = 7,11·10-3, 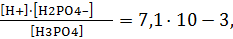
II-ступень – H2PO4– « H+ + HPO42– Кд2 = 6,34·10-8, 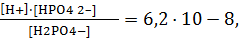
III-ступень – HPO42– « H+ + PO43– Кд3 = 1,26·10-12. 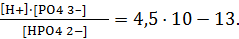
Из приведенных значений Kд видно, что каждая последующая ступень диссоциации примерно на пять порядков меньше.
5. pH водных растворов
Ионное произведение воды.
В чистой воде [H+] = 10–7 моль/л, в кислой среде [H+] > 10–7 моль/л, в щелочной среде [H+] < 10–7 моль/л.
Концентрации ионов H+ и OH– могут меняться в очень широких пределах, поэтому в расчетах удобнее использовать не значения концентраций, а их логарифмы (lg). Отсюда получаем:
| рН = -lg[H+]. | (3.17) |
Значок «p» обозначает математическую операцию «-lg», а [H+] – молярную концентрацию ионов водорода.
рН – это отрицательный десятичный логарифм из молярной концентрации ионов водорода.
Шкала рН имеет следующий вид:
0 7 14
ا-----------------------ا--------------------------ا
кислая нейтральная щелочная среды.
Примеры расчетов рН в растворах сильных и слабых кислот и оснований:
1) Рассчитать pH 0,1М раствора серной кислоты.
Решение:
H2SO4 ® 2H+ + SO42–,C(H+) = 2C(H2SO4) = 0,1·2 = 0,2 моль/л,
рH = -lg[H+] = -lg 2 ·10–1= -lg2 - lg10–1= -0,3 + 1 = 0,7.
2) Рассчитать pH в 0,1М растворе Н2СО3.
Решение:
Напишем уравнения диссоциации угольной кислоты:
Н2СО3 ↔ Н+ + НСО3– Кд1 = 5·10–7,
НСО3– ↔ Н+ = СО32– Кд2 = 5 ·10–11.
Расчет концентрации ионов водорода проведем только по первой ступени диссоциации:
[H+] = [НСО3–] = 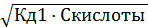 =
= 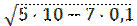 = 2,2·10-4 моль/л.
= 2,2·10-4 моль/л.
Отсюда, рН = -lg 2,2·10-4 = -0,34 + 4 = 3,64.
Из приведенных значений видно, что при одинаковой молярной концентрации сильные электролиты изменяют рН в значительно большей степени. При смешивании сильного и слабого электролитов рН практически определяется диссоциацией сильного электролита.
Буферные растворы – это растворы при добавлении к которым кислот или щелочей их pH меняется незначительно.
Буферными свойствами обладают:
1) Растворы слабых кислот и их солей. Например:
СН3СООН + СН3СООNа – ацетатный буферный раствор.
2) Растворы слабых оснований и их солей. Например:
NН4ОН + NН4Сl– аммонийный буферный раствор.
3) Растворы кислых солей слабых кислот. Например, NаН2РО4.
Дата добавления: 2015-08-21; просмотров: 2378;
