Способы выражения состава растворов
| Массовая доля (ω) – отношение массы растворенного вещества к массе раствора: ω(x) = m(x) ∕ m(раствора). |
Массовая доля выражается в долях от единицы или в процентах (в долях от ста). Процентная концентрация показывает, сколько граммов растворённого вещества содержится в 100 г раствора. Например: ω(Н2SО4) = 3% или 3% Н2SО4, т.е. в 100 г раствора содержится 3 г Н2SО4.
Молярная концентрация (С) – отношение количества молей растворенного вещества к объему раствора:
| С = n ∕ V |
Сокращенное обозначение молярной концентрации – М. На практике молярную концентрацию выражают обычно в моль/л. Например,
С(Н2SО4) = 2 моль/л или 2 М Н2SО4, т.е. в одном литре раствора содержится 2 моль Н2SО4.
На практике также применяются мольная доля, моляльная, нормальная и другие концентрации.
3. Растворы неэлектролитов
Неэлектролиты – вещества растворы которых не проводят электрический ток.
3. 1. Законы Рауля
Плавление, кипение и другие фазовые переходы для летучего вещества протекают при определенных значениях давлений паров над веществом. При переходе от чистого растворителя к раствору давление пара растворителя надраствором изменяется, что соответственно приводит к изменению температур кипения и замерзания растворов, а также осмотического давления.
Рассмотрим двухкомпонентный раствор:
растворитель – летучее вещество, это вещество которое можно перевести в газообразное состояние при атмосферном давлении,
растворенное вещество– нелетучее и не диссоциирующее на ионы (неэлектролит) вещество.
Количественно равновесное состояние между жидкостью и паром характеризуется давлением насыщенного пара. Обозначим:
р0 – давление насыщенного пара над чистым растворителем,
р – давление насыщенного пара над раствором.
Молекулы нелетучего компонента препятствуют улетучиванию из раствора молекул растворителя (какая-то часть поверхности просто занята ими), т.е. р0> р. Таким образом, давление насыщенного пара растворителя над раствором ниже, чем над чистым растворителем. Отсюда:
(р0 - р) – абсолютное значение понижения давления пара растворителя над раствором,
( 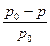 ) – относительное понижение давления пара растворителя над раствором.
) – относительное понижение давления пара растворителя над раствором.
В 1887г французский ученый Ф.М.Рауль открыл закон, согласно которому относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
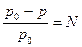
| (3.8) |
Из закона Рауля следует, что понижение давления пара над раствором не зависит от природы растворенного вещества, а зависит только от количества частиц растворенного вещества.
Уменьшение давления пара над раствором приводит соответственно к повышению температуры кипения и понижению температуры замерзания раствора. Практическим применением закона Рауля стали, выведенные на его основе, криоскопический и эбуллиоскопический законы. Данные законы позволяют рассчитать повышение температуры кипения и понижение температуры замерзания растворов нелетучих неэлектролитов.
Температура кипения – это температура при которой давление пара над раствором становится равным внешнему давлению. Для достижения раствором данного давления пара растворителя требуется более высокая температура в сравнении с чистым растворителем.
Температура замерзания – это температура при которой давление пара над раствором станет равным давлению насыщенного пара над кристаллами растворителя. Для раствора, в сравнение с чистым растворителем, температура замерзания ниже.
Криоскопический и эбуллиоскопический законы Рауля имеют вид:
| ΔТзам. = К·Сm – криоскопический закон, | (3.9) |
| ΔТкип. = Э·Сm – эбуллиоскопический закон | (3.10) |
где ΔТзам. – понижение температуры замерзания,
К – криоскопическая постоянная растворителя,
ΔТкип. – повышение температуры кипения,
Э – эбулиоскопическая постоянная растворителя,
Сm — моляльная концентрация растворенного вещества.
Значения криоскопических и эбулиоскопических констант для воды и бензола приведены в таблице 3.1.
Таблица 3.1 – Криоскопические и эбулиоскопические константы
| Растворитель | ТКИП, °С | Э, град·моль-1·кг | ТЗАМ, °С | К, град·моль-1·кг |
| Вода – Н2О | 0,52 | 1,86 | ||
| Бензол – С6Н6 | 80,1 | 2,53 | 5,5 | 5,12 |
Физический смысл криоскопических и эбулиоскопических констант следующий. Они показывают, на сколько градусов выше кипит и на сколько градусов ниже замерзает одномоляльный раствор (содержащий I моль растворенного вещества на 1кграстворителя) по сравнению с температурами кипения и замерзания чистого растворителя.
Криоскопическая и эбулиоскопическая константы не зависят от природы растворенного вещества, а являются характеристиками растворителя.
Законы Рауля широко применяются на практике. Например, 58 % (по массе) водный раствор этиленгликоля замерзает при температуре -50 °С.
4. Растворы электролитов
Дата добавления: 2015-08-21; просмотров: 785;
