ЛЕКЦИЯ № 2
ЛЕКЦИЯ № 1
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ.
КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Основные понятия химии
Окружающий нас мир материален. Материя существует в виде вещества и поля. Поле – вид материи не имеющий массы покоя.
Вещество – вид материи, обладающий при данных условиях определёнными физическими свойствами. Например, вода при стандартных условиях (25 0С, 1 атм.) бесцветная жидкость со следующими константами: мольная масса 18 г/моль, плотность 1 г/мл (при 4 °С), температуры фазовых переходов: замерзания и кипения составляют соответственно 0 °С и 100 °С (при р = 1 атм.), теплоемкость жидкой воды 4,18 Дж/г·К и др. константы.
Вещества состоят из атомов или молекул. Основы атомно-молекулярного учения впервые были изложены М.В. Ломоносовым в 1741 году.
Атом – электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Главной характеристикой атома является заряд ядра, равный числу протонов в атоме. В состав ядра, за исключением изотопа водорода 1Н, входят также нейтральные частицы нейтроны.
Элемент – разновидность атомов имеющих одинаковый заряд ядра.
Изотоп – вид атомов, имеющих одинаковый заряд ядра, но разную массу. Это связано с различным содержанием нейтронов в атоме одного элемента. Изотопы по физическим константам и химическим свойствам отличаются незначительно. Исключение составляют изотопы водорода: протий (Н) – 1Н, дейтерий (D) – 2Н и тритий (Т) – 3Н. При переходе от протия к дейтерию и тритию атомная масса возрастает соответственно в два и три раза, что приводит к значительному различию физико-химических свойств данных изотопов.
Молекула – это наименьшая частица вещества, обладающая его химическими свойствами.
Моль – это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С. Один моль атомов углерода 12С содержат 6,02·1023 (число Авогадро) атомов углерода. Например, один моль Н2SО4 содержит 6,02·1023 молекул Н2SО4.
Мольная масса – это масса одного моля вещества.
Например, М(Н2SО4) = 98 г/моль.
Количество молей вещества обозначается n(x) и вычисляется по формуле
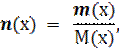
| (1.1) |
где 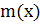 – масса вещества
– масса вещества 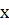 ,
,
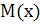 – мольная масса вещества
– мольная масса вещества 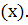
Например, n(Н2SО4) = 0,3 моль.
Мольная масса эквивалента вещества – это произведение мольной массы вещества на фактор эквивалентности данного вещества
| М[fэкв.(х)х] = М(х) · fэкв.(х), | (1.2) |
где М(х) – мольная масса вещества х,
fэкв.(х) – фактор эквивалентности вещества х.
Например, М(½Н2SО4) = 98 · ½ = 49 г/моль.
Фактор эквивалентности вещества – это число показывающее, какая доля атома или молекулы вещества эквивалентна в кислотно-основной реакции одному иону Н+ или в окислительно-восстановительной реакции одному электрону. Например: fэкв.(Н2SО4) = ½, fэкв.(А1) = 1∕3.
Количество моль эквивалентов вещества обозначается n[fэкв.(х)х]. Например, n(½Н2SО4) = 0,6 моль эквивалента Н2SО4.
2. Основные законы химии
Закон сохранения массы – масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения энергии – при любых взаимодействиях, имеющих место в изолированной системе, энергия этой системы остается постоянной и возможны лишь переходы одного вида энергии в другой в эквивалентных соотношениях.
Законы сохранения массы и энергии были открыты и экспериментально подтверждены М.В. Ломоносовым.
Закон постоянства состава – любые химически индивидуальные соединения имеют один и тот же количественный состав независимо от способа его получения.
Закон Авогадро – в равных объемах любых газов при одинаковых условиях содержится одно и то же число молекул. В газах расстояния между отдельными молекулами настолько велики, что собственный размер молекул практически не влияет на общий объем газа. На практике широко применяется следствие из закона Авогадро – один моль любого газа при нормальных условиях (0 0С, 1 атм.) занимает объем 22,4 л (мольный объем).
Закон эквивалентов – числа моль эквивалентов всех веществ, участвующих и образующихся в реакции, одинаковы. Для уравнения реакции записанного в общем виде аА + вВ = сС выполняется следующее соотношение:
| n[f экв.(А)А] = n[fэкв.(В)В] = n[f экв.(С)С]. | (1.3) |
Приведенные выше законы объединяют под общим названием стехиометрические законы. Они позволяют проводить расчеты по формулам веществ и по уравнениям реакций.
3. Основные классы неорганических соединений
3.1. Простые вещества
Простые вещества состоят из атомов одного элемента. Например: Н2, О2, Fe и т.д. Один элемент может существовать в виде нескольких простых веществ – аллотропических модификаций. Например, О2 – молекулярный кислород, О3 – озон.
Простые вещества делятся на металлы и неметаллы. Металлы, в отличие от неметаллов, обладают высокой электро- и теплопроводностью, пластичностью, ковкостью. По химическим свойствам металлы являются только восстановителями, а неметаллы – как окислителями, так и восстановителями. В соответствии с общими закономерностями изменения свойств элементов в периодической таблице, наиболее активным металлом является франций, а неметаллом – фтор. При движении в периодической таблице от франция к фтору металлические свойства ослабевают, а неметаллические усиливаются.
3.2. Сложные вещества
Сложные вещества состоят из атомов различных элементов.
К основным классам неорганических соединений относятся оксиды, кислоты, основания и соли. Например: СО2, Н2СО3, КОН, К2СО3 и т.д.
Оксиды – соединения элементов с кислородом. Оксиды делятся на две группы: солеобразующие и несолеобразующие.
Несолеобразующие оксиды – не образуют кислоты, основания и соли. Например: NO, CO и др.
Солеобразующие оксиды – при определённых химических реакциях образуют соли. Солеобразующие оксиды подразделяются на кислотные, основные и амфотерные.
Кислотные оксиды – при взаимодействием с водой образуют кислоты. Например, СО2+ Н2О = Н2СО3.
Основные оксиды – при взаимодействием с водой образуют основания.Например, Na2О + Н2О = 2NaOH.
Амфотерные оксиды – это оксиды проявляющие как кислотные так и основные свойства. Например:
Сr2О3 + 6НС1 = 2СrС13 + 3Н2О, Сr2О3 + 2NaOH= 2NaCrО2 + Н2О.
Примеры амфотерных оксидов: BeO, ZnO, А12О3, PbO, РbО2, Fe2О3 и др.
Названия оксидов образуются от слова «оксид» и названия элемента в родительном падеже. Если элемент образует несколько оксидов, то в название оксида включают валентность элемента. Например:
FeO– оксид железа(II), Fe2 О3– оксид железа(III).
Формулы соединений можно выражать посредством брутто-формул и графических формул. Например, для оксида алюминия:
брутто-формула – А12О3,
графическая формула — О=А1–О–А1=О.
Существуют также смешанные оксиды. Например, Fe3О4 стехиометрически состоит из двух оксидов FeО и Fe2О3.
Кислоты – соединения диссоциирующие в водном растворе на катионы водорода и анионы кислотного остатка. Сильные кислоты диссоциируют полностью и необратимо по всем ступеням, а слабые – обратимо и ступенчато. Например:
H2SО4 →2Н+ + SО42–;
Н2СО3 ↔ Н+ + НСО3–(I–ступень), НСО3–↔ Н+ + СО32– (II–ступень).
Названия бескислородных кислот состоят из двух частей: название элемента, образовавшего кислоту, а затем слово «водородная». Например: НС1 – хлороводородная, H2S– сероводородная и др.
Примеры названия кислородсодержащих кислот:
H2SO4 – серная кислота, H2SO3 – сернистая кислота.
Если оксид образует несколько кислородсодержащих кислот с разным содержанием молекул воды, то к названию кислоты с меньшим её содержанием добавляется приставка мета-, а при наибольшем её содержании приставка орто-. Например:
H2SiО3 – метакремниевая и H4SiО4 – ортокремниевая кислоты.
Основания – соединения диссоциирующие в водном растворе на гидроксид-ионы и катионы металла. Например:
Са(OH)2 → Сa2++ 2ОН–;
Fe(OH)2 ↔ FeОН+ + ОН– (I–ступень ),FeОН+ ↔ Fe2+ + ОН– (II–ступень).
Названия оснований состоит из слова «гидроксид» и названия катиона в родительном падеже. Например:
NaOH – гидроксид натрия, Fe(OH)3 – гидроксид железа(III).
Соли – соединения диссоциирующие на катион металла и анион кислотного остатка. Например, Аl2(SО4)3 → 2Аl3+ + 3SО42-.
Соли образуются в результате реакции нейтрализации. Это реакция взаимодействия кислоты с основанием или их оксидов приводящая к образованию нейтрального соединения (соли). Например:
Н2SО4 + 2NаОН = Nа2SО4 + 2Н2О,
Н2SО4 + Nа2О = Nа2SО4 + Н2О,
SО3 + NаОН = Nа2SО4 + Н2О,
SО3 + Nа2О = Nа2SО4.
Примеры названия солей:
Nа2SО4 – сульфат натрия, Nа2SО3 – сульфит натрия.
3.3. Оксиды, гидроксиды и соли элементов III-периода
На примере элементов III-периода составим формулы возможных оксидов и образуемых из них кислот, оснований и солей:
1) Оксиды:
Nа2О, МgО, Аl2О3, SiО, SiО2, Р2О3, Р2О5, SО2,SО3, Сl2О, Сl2О3, Сl2О5, Сl2О7;
2) Гидроксиды:
NаОН, Мg(ОН)2, Аl(ОН)3, Н3АlО3, Н2SiО3, Н3РО3, Н3РО4, Н2SО3, Н2SО4, НСlО, НСlО2, НСlО3, НСlО4;
3) Соли:
NаСl, МgCl2, АlCl3, К3АlО3, К2SiО3, К3РО3, К3РО4, К2SО3, К2SО4,КСlО, КСlО2, КСlO3, КСlО4.
Из приведенных формул видно, что в периодах с увеличением порядкового номера элемента основные свойства ослабевают, а кислотные усиливаются, проходя через амфотерные.
ЛЕКЦИЯ № 2
РАСТВОРЫ
1. Классификация систем, состоящих из двух и более веществ
Системы, состоящие из двух и более веществ, в зависимости от размеров частиц можно разделить на: дисперсные системы(10–3 ÷ 10–5 см), коллоидные растворы(10–5 ÷ 10–7 см) и истинные растворы(менее 10–7 см).
Дисперсная система – это система из двух или более веществ, в
которой одно или несколько веществ измельчено и равномерно распределено в другом.
Дисперсные системы термодинамически неустойчивы и с течением времени разделяются.
Коллоидный раствор –это система ,характеризующаяся такой степенью раздробленности компонентов при которой броуновское движение препятствует осаждению частиц.
Коллоиды по внешнему виду напоминают истинные растворы.
Коллоиды находятся в метастабильном состоянии и достаточно небольшого внешнего воздействия, чтобы началась коагуляция и разделение компонентов коллоидного раствора.
Истинный раствор – это система в которой растворённое вещество и растворитель измельчены до атомного или молекулярного уровня и равномерно распределены по всему объему раствора. Истинные растворы – термодинамически устойчивые системы. В последующем вместо названия истинный раствор будет применяться термин «раствор». Раствор – это однородная система, состоящая из двух или более компонентов.
Дата добавления: 2015-08-21; просмотров: 804;
