Клініка, діагностика та лікування хворих на ендометріоз
Ендометріоз– це гормональнозалежне, генетично обумовлене захворювання, що розвивається на фоні порушення імунного і ендокринного гомеостазу, суть якого полягає в розростанні тканини, ідентичної за своєю структурою та функцією з ендометрієм, але поза межами нормального розташування слизової оболонки матки (А.Н. Стрижаков, А.И.Давыдов, 1996; Л.В. Адамян, В.И. Кулаков, 1998; В.П. Баскаков и соавт., 2002; М.М. Дамиров, 2004).
Згідно викладенню у Наказі МОЗ України № 582 генітальний ендомтеріоз – доброякісне гормонально залежне захворювання, в основі якого лежить гетеротопія ендометрію на тлі порушення функції гіпоталамо-гіпофізарно-яєчникової системи, імунного дисбалансу при наявності генетичної схильності.
Системне вивчення ендометріозу як самостійного патологічного процесу почалося не так давно — в другій половині минулого сторіччя, хоча деякі відомості про це захворювання містяться вже в єгипетському папірусі, що датується близько 1600 років до н.е.
Перший морфологічний опис генітального ендометріозу в науковій медичній літературі зробив Van Rokitansky в 1860 р., який назвав патологічне утворення, виявлене ним в малому тазу жінки, аденоміомою. Пізніше, в 1861 р. він повідомив про ендометріоз яєчників, який назвав «cystosarcoma adenides ovarii uterinum». У той період про випадки ендометріозу докладали інші дослідники: F. Recklinghausen (1885), Т.S. Cullen (1896), Н.С. Иванов (1898) та W.W. Russell (1899).
У 1903 р. R. Меуer опублікував обширний опис захворювання, а J. Sampson (1921) повідомив про перфорацію геморагічних «шоколадних» кіст яєчника і назвав це явище «ендометріозом». J. Sampson також був першим, хто описав злоякісні зміни в позаматковій ендометріоїдній тканині.
З розвитком кульдоскопії і лапароскопії частота діагностування ендометріозу стала зростати. Е. Henriksen (1955) проаналізував 1000 випадків і показав, що 82% пацієнток з вищевизначеною патологією відносилися до вікової групи 30-45 років. Описано, що ендометріоїдна тканина може розташовуватися в порожнині тазу, на вагінально-ректальній перетинці, на стінках шлунково-кишкового, статевого і сечовивідного трактів, в рубцях після кесарева розтину та інших місцях. З цим явищем були пов’язані менорагія, дисменорея, глибока диспареунія, безпліддя.
В кінці XIX — початку XX в. були ідентифіковані і описані основні форми генітального ендометріозу (ендометріоїдна кіста яєчника, ендометріоїдні гетеротопії яєчника, очеревини малого тазу і ретроцервікальної області, а також різні форми аденоміозу). Надалі висувалися різні класифікації і теоретичні концепції етіології та патогенезу ендометріозу, а також основні види лікування цього захворювання.
До 70-х років ХХ сторіччя ендометріоз був рідкісним захворюванням, але в останні 35 років почалося експансивне зростання цієї патології серед жінок економічно розвинених країн, що дозволило називати ендометріоз «хворобою цивілізації» (Н.В. Старцева, 1997).
ТЕРМІНОЛОГІЯ
Термін «аденоміоз» вперше був введений С. Vоn Rokitansky в 1860 р., а «ендометріоз» — В. Веll в 1892 р. У літературі продовжується дискусія з приводу визначення ендометріозу. Так, J. S. Sanfilippo (1994) описує цю патологію як «ектопічне розташування ендометрія», а А.F. Наnеу (1991), S.K. Smith (1991) — «наявність поза маткою не ендометрія, а тканин, гістологічно подібних ендометрію».
Б.І. Железнов, А.Н Стрижаков (1985) та інші дослідники підкреслюють, що ендометріоз — це ендометріоїдні розростання за межами звичайної локалізації ендометрія, тобто він може бути як в тілі самої матки — внутрішній ендометріоз, так і поза маткою — зовнішній ендометріоз. У той же час А.F. Наnеу (1991) вважає, що «внутрішній ендометріоз матки» необхідно розглядати як абсолютно особливе захворювання і називати його «аденоміозом».
Перегляд термінів і визначень, що стосуються даної патології, обумовлений впровадженням високочутливих методів діагностики і нових методів лікування. Так, в результаті широкого застосування з діагностичною і лікувальною метою ендоскопічних методів було показано, що частіше зустрічаються ендометріоїдні вогнища на очеревині малого тазу, і в більшості випадків вони не викликають яких-небудь клінічних симптомів хвороби. Більш того, при повторній лапароскопії виявляють безслідне зникнення цих вогнищ без якого-небудь лікування.
Таким чином, було доведено, що ендометріоїдні вогнища можуть виникати на очеревині практично у кожної жінки дітородного віку, існувати всього декілька днів і швидко зникати, не викликаючи ні необоротних локальних змін, ні реакції організму у вигляді яких-небудь симптомів ендометріозу.
У відношенні термінології заслуговує уваги діагноз “ендометріоїдна карцинома”. На справді “ендометріоїдна карцинома” (відповідно пояснювальним зауваженням ВООЗ до гістологічної класифікації пухлин яєчників) тільки підкреслює гістологічну ідентичність цих пухлин з ураженнями ендометрію (А.Н.Стрижаков, 2000).
В даний час прийнято, називаючи яку-небудь хворобу як нозологічну форму, об’єднувати в єдиному формулюванні відомі за науковими дослідженнями дані про етіологію, патогенез, динаміку клінічної картини і морфофункціональних зрушень, про терапію, прогноз, профілактику та експертизу працездатності.
Тривалий перебіг, важкість клінічних проявів, прогресуючий розвиток, частота втрати трудової діяльності, порушення репродуктивної функції говорять як про медичне, так і про соціальне значення хвороби. З цих позицій видно, що ендометріоз займає важливе місце в патології організму жінки, що дає основу вважати його хворобою всього організму - ендометріоїдна хвороба (В.П.Баскаков и соавт, 2002; Е.В.Коханевич и соавт., 2006).
Епідеміологія. Частота ендометріозу серед оперованих гінекологічних хворих. Питома вага ендометріозу в структурі показань до хірургічного лікування становить 0,7 – 0,9 % В той же час, в останні роки спостерігається стійка тенденція до збільшення частоти генітального ендометріозу (А.Н.Стрижаков и соавт., 2000).
Що стосується загальної популяції жінок репродуктивного віку, у яких є менструації, то частота ендометріозу знаходиться в широких межах – від 6,2 до 50 % (А.Н.Стрижаков, А.И.Давыдов, 1996; Л.В.Адамян, В.Л.Кулаков, 1998; B.Eskenazi, M.L.Warner, 1997).
Ендометріоз частіше зустрічається у віці 40-44 роки. В період пре- та пост менопаузи частота ендометріозу становить 2 – 5 %. Його виявлено у 50% дівчаток підліткового віку, яких оперували з приводу тазового болю ( Е.В. Коханевич та співавт., 2006).
Макро- і гістологічна структура ендометріозу. Макроскопічно ендометріоз може мати форму вузлів, інфільтратів або кістозних утворень, порожнина яких заповнена геморагічним вмістом (густа коричне рідина, яка за зовнішнім виглядом нагадує шоколад). Необхідно відзначити, що ендометріоз має здатність до інфільтруючого росту в навколишні тканини з деструкцією останніх внаслідок власної ферментативної активності (Е.В.Коханевич и соавт., 2006). Крім цього, ендометріоз здатний розповсюджуватись по кровоносним і лімфатичним судинам, а також дисемінуватись внаслідок порушення щільності стінок його кістозних форм.
Гістологічна структура ендометріозу нагадує будову ендометрію (поєднання залозистого ендометрійподібного епітелію та цитогенної строми). Однак, на відміну від незміненої слизової оболонки тіла матки, ендометріоїдна тканина менш здатна до циклічних змін, зокрема, під впливом прогестерону, у вогнищах ендометріозу не відбувається повноцінна секреторна трансформація і, в цілому, ендометріоз досить слабо реагує на вплив екзогенних гормонів (А.Н.Стрижаков и соавт., 2000).
Умовно ендометріоїдні гетеротопії можна розділити на три типи: залозисті (більшу частину складає залозистий компонент), стромальні (більшу частину представляє стромальний компонент, а залозисті структури відсутні), змішані (обидва компоненти представлені в рівній кількості) (Е.В.Коханевич и соавт., 2006).
Відсутність сполучнотканної капсули, здатність до інфільтруючого росту та метастазування в сукупності зближають ендометріоз з пухлинним процесом. В той же час, на відміну від справжньої пухлини для ендометріозу не є характерним: а) клітинний атипізм; б) прогресуючий автономний ріст; в) відсутність взаємозв’язку між клінічними проявами і станом менструальної функції. Крім цього існує суттєва різниця у взаємовідношенні з вагітністю. Відомо, що вагітність стимулює експансивний ріст ракової пухлини. Навпаки, для хворих на ендометріоз фізіологічний перебіг вагітності є сприятливим чинником – тривалий вплив гормонів жовтого тіла та плаценти на вогнища ендометріозу сприяє їх інактивації (А.Н.Стрижаков и соавт., 2000). Онкологічний аспект ендометріозу є однією з найбільш дискусійних проблем. Сьогодні не обговорюється безпосередня можливість малігнізації захворювання. Основу суперечки з цього питання складають відомості про частоту злоякісної трансформації ендометріозу, що становить від 0,1 – 0,9 % до 11 – 24 %.
На думку Б.И.Желєзнова (1978), відомості про високу частоту злоякісної трансформації внутрішнього ендометріозу зумовлені неточностями у термінології. Зокрема, в термін “стромальний ендометріоз” іноді помилково включають різноманітні патологічні процеси, в тому числі стромальну ендометріальну саркому. Однак в подібній ситуації основою злоякісної пухлини є не ендометріоз, а ендометріальна строма. З урахуванням вище сказаного виникає закономірне питання: яка онкологічна настороженість геніального ендометріозу? На думку А.Н.Стрижакова та співавторів (2000) не потрібно перебільшувати ступінь малігнізації ендометріозу. Можливим підтвердженням подібного погляду є відсутність (або дуже рідкі спостереження) злоякісного переродження ендометріозу шийки матки, маткових труб, піхви.
ЕТІОЛОГІЯ І ПАТОГЕНЕЗ
Не дивлячись на численні дослідження, етіологія і патогенез ендометріозу до кінця залишаються невивченими. З появою нових даних все більше число дослідників схиляється до висновку про поліетіологічність ендометріозу – коли в патологічний процес включається багато систем організму. В процесі вивчення ендометріозу виникають нові проблеми, зокрема: що називати ендометріозом, чи є патологічним процес ектопічної трансплантації ендометрія (настільки часто, що на підставі цього критерію можна зробити висновок: близько половини жінок страждає ендометріозом) або вважати його захворюванням тільки тоді, коли є клінічні прояви? На жаль, при клінічній оцінці не враховується залежність між поширеністю ендометріозу і вираженістю основних симптомів. У третини хворих тяжкість больового синдрому не відповідає стадії захворювання, тобто при поширених формах ендометріозу перебіг захворювання безсимптомний, тоді як у значного числа хворих з “малими формами” ендометріозу – виявляється у вираженій альгодісменорєї і безплідді. Значні успіхи, які досягнуті в розвитку гормонального і хірургічного лікування з використанням прогресивних ендоскопічних методів, не забезпечують тривалого ефекту, а при цьому основною невирішеною проблемою є рецидиви захворювання. До того ж, в даний час склалося уявлення про те, що наявність ендометріоїдних імплантатів не обов'язково означає присутність захворювання. Багато дослідників дійшли висновку, що „малі форми” ендометріозу можуть бути нормальним явищем, які спонтанно з’являються й зникають, і таким, що не мають тенденції до прогресування. Викликають інтерес повідомлення про результати лапароскопії у жінок з „малими формами” ендометріозому і з легким ступенем розповсюдження, що не одержували лікування: у 38% випадків через шість місяців ендометріоз залишався стабільним, у 32% спостерігалося прогресування захворювання, а у 30% відмічено самовилікування (P.A. Maouris, 1991).
На сьогоднішній день існує декілька теорій патогенезу ендометріозу (И.С. Сидорова и соавт., 2002; О.А. Берестовой; 2003; Г.М. Савельева, В.Г. Бреусенко, 2004).
Теорія ембріонального та дисонтогенетичного походженняендометріозу, вперше висунута F.Recklingausen у 1896 р. До теперішнього часу вона знаходить прихильників, оскільки може пояснити виникнення ендометріозу у дітей, а також часте його поєднання з аномаліями розвитку геніталій. Згідно цієї теорії, ендометріоїдні гетеротопії виникають із залишків парамезонефральних (мюллерових) протоків або із зміщених ділянок зародкового матеріалу
(V. Homstein, 1992; R. Kossman, 1997), з якого в процесі ембріогенезу формуються жіночі статеві органи (зокрема, ендометрій).
Певне значення в генезі ендометріозу надається спадковому чиннику, оскільки є спостереження сімейної схильності до цього захворювання. Поширеність ендометріозу зростає серед сестер хворих в 5-6 разів в порівнянні з його частотою в загальній популяції (G.L. Simpson et all., 1980; A.K. Magnus at all., 1993). Передбачається, що розвиток ендометріозу зумовлений мультифакторіальною спадковістю (сума генетичних і середовищних чинників). Однак вона не знайшла серйозного експериментального та клінічного підтвердження.
Імплантаційна теорія (теорія ретроградної менструації) –до теперішнього часу має багато прихильників. Суть її полягає в тому, що елементи ендометрія заносяться в інші тканини статевих органів, імплантуються і утворюють ендометріоїдну гетеротопію. Це може відбуватися при ретроградній менструації, або під час гінекологічних операцій. Передбачається можливість метастазування частинок ендометрію лімфогенним і гематогенним шляхами з подальшою їх імплантацією навіть екстрагенітально. Гіпотеза про ретроградну менструацію була висунута G.A.Sampson в 1921 р., вони характерні і для здорових жінок. Так, за даними багатьох авторів, живі клітини ендометрія в перитонеальній рідині виявлені у 70% жінок (M.A. Koninckx at all., 1980; L.H.Badanyet, 1984; D.G. Bartosik at al., 1986; K.O. Kruitwagen та at al., 1991). У зв'язку з цим були досліджені різні механізми, які контролюють імплантацію клітин ендометрію і/або запуск метаплазії. Певне значення мають чинники, які здатні ініціювати активну проліферацію елементів ендометрію. Дослідження останніх років дозволили ідентифікувати сполучення білкової природи, що володіють вираженою проліферативною активністю, які одержали загальну назву чинників зростання. Такі сполучення можуть викликати проліферацію самих різних тканин і особливо тих, які здатні до експансивного зростання (S.K.Smith, 1994). Сьогодні встановлені EGF, ісуліноподібний чинник росту, трансформовані чинники росту, чинник росту фібробластів та ін. Виявлено, що тканина ендометріоїдних гетеротопій має рецептори до цих агентів, причому їх рівень в перитонеальній рідині при ендометріозі вищий, ніж в нормі (J.C. Huang, J. Ieh, 1994). У перитонеальній рідині підвищена концентрація макрофагів, які здатні продукувати різні пептидні чинники росту (цитокіни): інтерлейкіни, чинник некрозу пухлин (TNF), чинник росту (VEGF), стимулюючі проліферацію ендотеліальних клітин. Функціональна активність цитокінів виявляється в регуляції взаємодії макрофагів з елементами тканин, формуванні вогнищ запалення, набряку, пірогенних реакцій, імуномодуляції, що дозволяє вважати їх універсальними регуляторами процесів запалення (S. Acira at al., 1990; C. Bernar at al., 1994; D.N. Granger, P. Rubes, 1994). Цитокіни сприяють клітинній проліферації, у тому числі і ендометріоїдних гетеротопій, що ініціює імплантацію ендометрія при ретроградній менструації. Доведено: цитокіни порушують перебіг постовуляторного періоду, викликають запальні зміни в тканині яєчника і сприяють розвитку ендометріоїдних кіст (S. Uda, 1992; T. lshimaru та співавт., 1994). Проведені дослідження дозволяють припустити, що одним з методів лікування хворих з ендометріозом може стати застосування агентів, які регулюють синтез цитокінів, або що є антагоністами їх рецепторів (A. Leter, M. Maxl, 1993).
На користь імплантаційної теорії свідчать наступні факти:
1) наявність у ретроградній менструальній крові живих і здатних до імплантації в навколишні тканини клітин ендометрія;
2) переважно локалізацією ендометріоїдних гетеротопій є крижово-маткові зв’язки, очеревина, прямокишково-маткове поглиблення і задні листки широких зв’язок – тобто, поверхні, які розташовані поблизу отворів маткових труб і підпадають під дію менструальної крові;
3) у відповідності із законом про всесвітнє тяжіння клітини ендометрія, які проникають в черевну порожнину через маткові труби, осідають на очеревині та органах малого тазу, в зв’язку з чим ендометріоз верхніх відділів очеревини зустрічається дуже рідко;
4) імплантація клітин ендометрія відбувається головним чином, на нерухомих структурах малого тазу, оскільки для її повного завершення потрібен відповідний час. Це положення підтверджує відносно низька частота ендометріоза мобільних органів (маткових труб, різних відділів тонкого кишечнику);
5) процес імплантації клітин ендометрія в навколишні тканини і органи визначається характером їх кровообігу;
6) на користь цієї теорії свідчить висока частота ураження ендометріозом яєчників, тому, що яєчники є ідеальною зоною для імплантації ендометріоїдних клітин. Цьому сприяє продукція гонадами естрогенів, їх нерівна поверхня і знаходження поблизу отворів маткових труб, висока васкуляризація і періодичне пошкодження цілісності зародкового епітафія під час овуляції (А.Н.Стрижаков и соавт., 2000). В той же час імплантаційна теорія не дає відповіді на запитання – чому регургітація менструальної крові, яка спостерігається у 90% жінок з прохідними матковими трубами, не співпадає з частотою геніального ендометріозу в загальній популяції. Аналіз причин, що сприяють імплантації, дозволяє зробити наступні висновки:
а) тільки окремі життєздатні клітини ендометрія, які проникають внаслідок ретроградної менструації в черевну порожнину, володіють здатністю до вторгнення в навколишні тканини;
б) в нормі в перитонеальній рідині міститься висока концентрація статевих стероїдних гормонів, яка значно перевищує їх рівень в плазмі крові і забезпечує інактивацію ендометріальних клітин, що поступають в черевну порожнину;
в) в розвитку ендометріоза відповідна роль належить об’єму менструальної крові, що попадає в черевну порожнину. Кількість ретроградної менструальної крові залежить від тривалості менструації, стану каналу шийки матки, матково-трубного простору.
Метапластична теорія генезу ендометріозу припускає метаплазію ембріональної очеревини або целомічного епітелію, що перетворюються під впливом гормональних порушень, запалення, механічної травми або інших пошкоджуючи факторів в ендометріоїдну гетеротопію. Джерелом ендометріозу при цьому є елементи ембріонального целомічного епітелію, який розташовується між зрілими клітинами мезотелію очеревини. H. Minh та співавт. (1986) вважають, що ендометріоїдні вогнища походять з клітин целомічного епітелію, персистуючого в перехідній зоні між міометрієм і ендометрієм. Подібні клітини з’являються в мезотелії яєчника, маткових труб і очеревини при дії дегенеруючої ендотеліальної тканини під час менструації.
На відміну від зрілого мезотелію очеревини елементи ембріонального целомічного епітелію, які вкраплені між зрілими клітинами мезотелію, можуть трансформуватися в матково-трубний епітелій. Ця думка підтримується з позицій гістогенезу пухлин яєчників. Зокрема відомо, що в гістогенетичному відношенні епітеліальні новоутворення яєчників розглядаються як пухлини парамезонефроїдного (мюллерового) походження. Незважаючи на те, що яєчники розвиваються не з мюллерового протоку (який дає початок матці і матковим трубам), джерелом цих пухлин є поверхневий (зародковий) епітелій гонад, який розвивається із целомічного епітелію. Останній дає початок парамезонефральним протокам, із яких формується трубний, ендоцервікальний і ендометріальний епітелій. Це дає змогу думати, що целомічний епітелій гонад володіє здатністю до перетворення (метаплації) в епітелій різного виду, в тому числі, і ендометріоїдного типу.
Проти целомічної метаплазії існують такі аргументи:
1) якщо епітелій очеревини володіє високою потенціальною здатністю до метаплазії, то можна б очікувати виску частоту розповсюдження ендометріоза у чоловіків. В той же час такі випадки поодинокі (всього описано 4 випадки) і при цьому діагностований рак передстатевої залози, а лікування проводилось великими дозами препаратів, що містили естрогени і ознаки ендометріозу (точніше окремі залозисті фрагменти) встановлені в тканині передстатевої залози, яка у чоловіків є залишком мюллерового протоку;
2) з позиції теорії целомічної метаплазії ендометріоїдні вогнища очеревини повинні характеризуватися однорідністю гістологічної структури, а це не відповідає дійсності;
3) відповідно з цією теорією ендометріоїдні перетворення повинні з однаковою частотою відбуватися у всьому целомічному епітелії, який вистилає як черевну, так і грудну порожнину. В той же час ендометріоз органів грудної клітини зустрічається дуже рідко;
4) вік пацієнток і частота виявлення ендометріозу повинні би знаходитись у прямопропоційній залежності, тобто вік захворюваності повинен відповідати постменопаузальному періоду. В той же час відомо, що в більшості спостережень на ендометріоз хворіють жінки репродуктивного віку (А.Н.Стрижаков и соавт., 2000).
Розглядається можливість перетворення ендотелію лімфатичних судин, мезотелію очеревини і плеври, епітелію канальців нирок та інших тканин в ендометріоподібну тканину. Ця теорія була підтверджена експериментально. Проте дослідження останніх років піддали критиці цю єдину теорію гістогенезу зовнішнього і внутрішнього ендометріозу.
Теорія гематогенного та лімфатичного генезу показує можливість гематогенного та лімфатичного шляху розповсюдження часток ендометрію з емболізацією у віддалені ділянки тіла, що може пояснити рідкі випадки виявлення ендометріозу за межами черевної порожнини (шкіра, суглоби, нирки та легені).
Теорія ятрогенної дисемінаціїприпускає, щовнутрішньоматкові медичні маніпуляції можуть сприяти безпосередньому проростанню ендометрія в стінку матки, що приводить до розвитку аденоміозу.
Генетична теоріяпідтверджує наявність сімейних форм ендометріозу, їх високу частоту серед хворих з вадами розвитку геніталій. Щодо генетично обумовленого виникнення генітального ендометріозу був вивчений взаємозв'язок поліморфізму між 306-основною парною вставкою в інтрон-G рецептора прогестерону і ендометріозу. Встановлено, що частота мутанта алелі у жінок з ендометріозом була більшою, ніж в групі контролю.
Відомо, що ендометріоз є кластером всередині нуклеарних сімейств. Існує генетична схильність, при цьому ризик захворювання слабшає при збільшенні родинної дальності. Вивчення сімейного анамнезу вказує на те, що ризик розвитку цієї патології виростає в 7 разів у сестер і матері пацієнток. Про це свідчить і той факт, що захворювання виникає приблизно в одному віці у пар сестра-сестра, дочка-матір. Загальна генетична схильність до розвитку ендометріозу, певно, пов’язана із спадкуванням типу імунного реагування (Е.В.Коханевич и соавт., 2006).
Гормональна теоріязаймає особливе місце в патогенезі ендометріозу. Спостерігаються зміни нейроендокринної ланкирепродуктивної системи гіпоталамус-гіпофіз-яєчники (А.Н. Стрижаков, А.И.Давидов, 1996; Л.В. Адамян та співавт., 1998). Автори відзначають частий розвиток ендометріозу на тлі високого індексу перенесених бактеріальних і вірусних інфекцій, порушень менструальної функції в пубертатному періоді, ускладнених пологів, абортів, стресових ситуацій. Патологія періоду пубертата гальмує становлення системи гіпоталамус-гіпофіз-яєчники, яка регулює розвиток репродуктивної системи. Внаслідок чого всі несприятливі чинники підсилюють нейроендокринні розлади. Тому порушення секреції гонадотропних гормонів і стероїдогенезу в яєчниках (хаотичні пікові викиди ФСГ і ЛГ, зменшення базального рівня прогестерону, гіперестрогенія) створюють умови для розвитку ендометріоїдних імплантатів і підтримки їх активного стану.
Не дивлячись на те, що всіма визнається гормональна залежність ендометріозу, в численних дослідженнях вмісту гормонів в крові хворих яких-небудь закономірностей не виявлено (J. Cbalmers, 1975; В.П. Баскаков и соавт., 2002; А.Н.Стрижаков, Б.И. Железнов, 1985). Автори відзначали лише деяке зниження стероїдогенної функції яєчників, що виявляється не різко вираженою неповноцінністю жовтого тіла.
У значної частини хворих на ендометріоз (20-45%) існує нормальний двофазний менструальний цикл, немає суттєвих змін з боку концентрації гіпофізарних, яєчникових, наднирникових гормонів. В той же час, спостерігається взаємозв’язок таких захворювань як синдром полікістозних яєчників (з хронінчною ановуляцією) і ендометріоз. Це говорить на користь наявності змін у ритмічності секреції гонадотропін-рилізінг гормонів у хворих на ендометріоз (Е.В.Коханевич и соавт., 2006). Вважають, що естрогени сприяють розвитку і розповсюдженню вогнищ ендометріозу. Про це свідчить і те, що на ендометріоз частіше хворіють жінки репродуктивного віку. Відомо, що клітини ендометріоїдних гетеротопій реагують на ріст, тобто відбуваються проліферативні, в меншому ступені секреторні, зміни, десквамація, внаслідок чого виникають крововиливи, аж до утворення кіст. Також визначено, що величина індукції рецепторів в функціональному шарі ендометрія значно більше, ніж в базальному і в міометрії, в зв’язку з чим, ендометрій більше реагує на гормональний вплив змінами своєї маси, ніж міометрій.
Імунна теорія– ендометріоз розвивається на фоні порушення імунного гомеостазу, що виражається імунодефіцитними станами і ознаками аутоімунізації (недостатність Т-клітинного імунітету, пригнічення функції Т-супресорів, активізація гіперсенсибілізації сповільненого типу).
Добре відомо, що нейроендокринна система репродукції і імунна система мають низку характерних загальних особливостей морфо-функціональної організації і знаходяться в тісній взаємодії. У обох системах виявлені і хімічно ідентифіковані загальні білки, регуляторні пептиди, що продукуються в них (тімозін, ендорфіни і енкефаліни). Зв’язуючись з опіатними рецепторами імунокомпетентних клітин, опіоїдні пептиди модулюють їх активність і забезпечують взаємодію нейроендокринної та імунної систем. У хворих ендометріозом виявлена дисфункція імунної системи, що характеризується Т-клітинним імунодефіцитом, пригніченням функції Т-супресорних клітин, що продукують хелперний чинник; поліклональною активацією В-лімфоцитарної системи. Ці зміни корелюють з порушенням стероїдогенезу в яєчниках. Сформульована концепція імунних механізмів патогенезу ендометріозу, провідну роль в якому грає дефіцит імунорегуляторних Т-супресорних клітин, що приводить до порушення диференціювання і проліферації ендометріальних клітин і функцій нейроендокринної системи. Доведено, що при ендометріозі має місце зниження цитотоксичності клітин – природних кілерів до аутологічного ендометрію, а також зниження їх активності в крові і перитонеальній рідині (H.A. Oosterlynck at al., 1991). Є ціла низка повідомлень з різних медичних центрів, які свідчать, що у жінок з ендометріозом присутній ризик підвищення рівня антиендометріальних антитіл (D.H. Barlow, K.A. Fernander, 1995). Під час лікування рівень антитіл може знижуватися. Патологічна активність поліклональних В-клітин, яка виявлена у хворих на ендометріоз, є класичною ознакою аутоімунного захворювання (N. Cleicher, 1987). Останнім часом велика увага відводиться ролі апоптозу і цитокінів в патогенезі хвороби. Сутність апоптозу: клітини, що включені в програму самоліквідації експресують гени, що індуктують апоптоз, та відповідно продуктують білки «домени смерті», при цьому має місце активація ендонуклеаз, що фрагментують ДНК та ядро.
Доведено порушення балансу молекулярно – генетичних показників процесів проліферації та апоптозу (абсолютно низький апоптоз та висока проліферативна активність) у вогнищах ендометріозу та гіперплазованому ендометрії.
В роботах останніх років висвітлено додаткові фактори ризику ендометріоідної хвороби: репродуктивний вік, порушення менструальної функції, неплідність в анамнезі: чисельні аборти та діагностичні вишкрібання порожнини матки; тривале використання гормональних контрацептивів; вади розвитку геніталій; ретроградні менструації, порушення функції підшлункової залози та печінки; запальні захворювання внутрішніх статевих органів, що призводять до ановуляції та недостатності функції жовтого тіла; внутрішньоклітинні патогени (вірусні, хламідійні, уреаплазменні; хірургічні втручання на матці, у тому числі кесарів розтин, консервативна міомектомія та операції на додатках матки; стресові фактори; анаболічна дія гормональних препаратів; погіршення екологічних обставин.
Проблема ендометріозу є особливо актуальною для молодих жінок, оскільки захворювання супроводжується значними порушеннями репродуктивної та менструальної функцій, стійким больовим синдромом, порушенням функції суміжних органів, а також погіршенням загального стану хворих, зниження працездатності.
На сьогодні роль імунної системи в патогенезі ендометріозу не тільки ніким не заперечується, але й ставиться на одне з перших місць.
Порушення гормонального і імунного гомеостазу не є безпосередньою причиною формування ендометріозу. Вони виконують роль чинників, що спричиняють виникнення патологічного процесу.
Найбільш важливим є не абсолютне підвищення рівня гонадотропінів або стероїдних гормонів, а порушення закономірностей, що лежать в основі діяльності гіпоталамо-гіпофизарно-яєчникової системи як єдиного функціонального комплексу.
Накопичені медичною наукою і практикою знання свідчать про те, що не може бути єдиної теорії походження ендометріозу для всіх локалізацій (матка, яєчники, труби, зв'язки, сечовий міхур, кишечник, м'язи, легені, тощо). Але безперечна провідна роль загальних умов, серед яких нейрогуморальний стан організму заслуговує особливої уваги.
Якщо виходити з уявлення про гіпоталамус як про інтеграційний апарат мозку, що забезпечує цілісні форми поведінки, адаптацію до змінних умов зовнішнього і внутрішнього середовища, то наявність змін в регуляції вегетативних, соматичних і психоемоційних функцій служить доказом порушення функціонального стану даного рівня ЦНС і свідчить про певну роль вказаних чинників в генезі деяких форм ендометріозу.
Л.В. Адамян і В.І. Кулаков (1998) на основі вивчення взаємозв’язків генетичних чинників, онкоантигенів, імунних зрушень, змін рівня гормонів та інших чинників розробили оригінальну схему патогенезу ендометріоїдних уражень. На їх думку, провідна роль в розвитку ендометріозу належить генетичним чинникам, які можуть обумовлювати як аномалії розвитку, що сприяють, наприклад, ретроградним менструаціям, так і прямі або онкогенопосередковані порушення імунного статусу. Крім того, розвитку ендометріоїдних уражень як мультифакторної патології, можуть сприяти умови навколишнього середовища, порушення гормонального статусу тощо.
На жаль, жодна з цих концепцій не в змозі пояснити ключовий момент розвитку ендометріозу - імплантацію і перетворення клітини ендометрія в ендометріоїдне вогнище. Очевидно, цей процес неможливий без наступних умов:
1. Регургітовані” клітини ендометрію володіють підвищеною здібністю до виживання, адгезії, імплантації і проліферації.
2. „Захисні” чинники організму (черевної порожнини) не в змозі забезпечити знищення (загибель) ектопічних ендометріальних клітин.
Таким чином, основним висновком зі всієї гамми теорій і аспектів хвороби є мультифакторність розвитку і перебігу генітального ендометріозу. До факторів ризику можна віднести наступні:
1. Наявність в анамнезі патологічних пологів, акушерсько-гінекологічних операцій (кесарів розтин, аборти, вишкрібання порожнини матки, електрокоагуляція, електроексцизія шийки матки, кріодеструкція), наявність коротких менструальних циклів, тривалих періодів менструальних кровотеч.
2. Гормоніальні порушення.
3. Тривале носіння ВМК.
4. Наявність ендометріозу у матері, сестер.
5.Зниження імунологічної толерантності (Е.В.Коханевич и саоавт., 2006)
КЛАСИФІКАЦІЯ
Основну частину всіх локалізацій ендометріозу складає генітальна форма(92-94%). Значно рідше зустрічаються екстрагенітальні осередки ураження (легенів, шлунково-кишкового тракту, сечовивідних органів, пупка, очного яблука, післяопераційних рубців) – 6-8 % (Е.В.Коханевич и соавт., 2006). Найчастішою локалізацією генітального ендометріозу є ураження матки – аденоміоз (внутрішній ендометріоз) – рис.1.
Питома частота аденоміозу досягає більше 70-90% серед всіх випадків ураження генітальним ендометріозом, тоді як зовнішній ендометріоз діагностується у значно меншого числа хворих. При аденоміозі відбувається розвиток гетеротопічних вогнищ в м'язовій оболонці матки, її перешийку, інтерстиціальному відділі маткових труб, тоді як при зовнішньому ендометріозі спостерігається ураження зовнішніх статевих органів, піхви і вагінальної порції шийки матки, ретроцервікальної області, яєчників, маткових труб, очеревини, що вистилає поглиблення малого тазу.
Тому при аденоміозі тіла матки проростання ендометріоїдних вогнищ в цей орган мають різноманітні ступені розповсюдження. Впродовж останніх 50 років запропоновано понад 10 різноманітних класифікацій ендометріозу.
Шифр МКХ-10 – N 80
N80 Ендометріоз
N80.0 Ендометріоз матки
Аденоміоз
N80.1 Ендометріоз яєчника
N80.2 Ендометріоз маткової труби
N80.3 Ендометріоз тазової очеревини
N80.4 Ендометріоз прямокишково-піхвової перетинки і піхви
N80.5 Ендометріоз кишечника
N80.6 Ендометріоз шкірного рубця
N80.8 Інший ендометріоз
N80.9 Ендометріоз, неуточнений
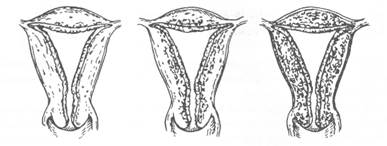
| Стадія I | Стадія II | Стадія III |
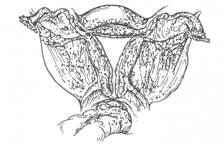
Стадія IV
Рис. 1. Класифікація внутрішнього ендометріозу в залежності від розповсюдження процесу
Клінічні форми ендометріозу
(В.П. Баскаков и соавт., 2002)
Дата добавления: 2015-07-14; просмотров: 1220;
