Окислительно-восстановительный (электродный) потенциал.
При обсуждении ОВР удобно процессы, происходящие с окислителем и восстановителем, записать в виде уравнений полуреакций восстановления окислителя и окисления восстановителя. Запишем простой пример:
Zn + 2HCl = ZnCl2 + H2
Ок-ль: 2Н+ + 2е = Н2 (восстановление)
Вос-ль: Zn -2e = Zn2+ (окисления)
Zn + 2H+ = Zn2+ + H2
В ОВП принимают участие две пары сопряженных окислителя и восстановителя, и направление реакции определяется тем, какой окислитель и какой восстановитель сильнее. Мерой силы окислителя является его стремление принять электроны, т.е. восстановиться, а мерой силы восстановителя – его стремление отдать электроны.
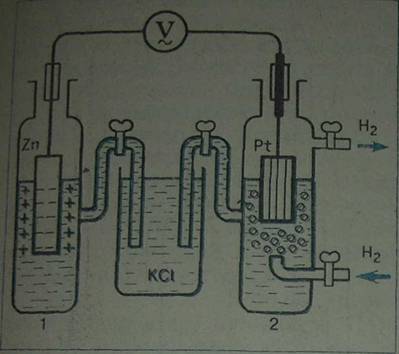
Рис. 1. Электрохимическая цепь со стандартным водородным электродом: -стандартный водородный электрод, 2-исследуемый электрод, 3 - электролитический ключ
Можно на опыте провести ОВП таким образом, чтобы электроны передавались от окислителя к восстановителю не непосредственно при столкновении, а через дополнительный проводник – металлическую проволоку. Для этого возьмем ту же систему, включающую две сопряженные пары окислитель-восстановитель, но разделим их пространственно, как показано на рисунке. В левый сосуд опущен цинк в раствор его соли (сульфата или нитрата цинка) – это цинковый электрод. Понятие электрод в электрохимии – это контакт электронного и ионного проводника (например, металла в растворе соли металла). Условное обозначение таких металлических электродов: Ме/Меп+. Чтобы стандартизировать измерения, концентрацию ионов цинка следует взять равной единице, а внешние условия – температуру и давление стандартными ( 298К, 1,01 Па).
Во второй сосуд помещен так называемый водородный электрод (нормальный водородный электрод). Он устроен намного сложнее. Немножко другая конструкция такого электрода представлена на рис.2.
Он представляет собой сосуд с одномолярным раствором серной кислоты, через который непрерывно пропускают водород под давлением 1 атмосфера при температуре 298К; в раствор опущена платиновая пластинка, покрытая черненной пористой платиной). Роль платины заключается в обеспечении проводимости между внешней цепью и раствором, а также катализе гетерогенного равновесного процесса окисления водорода и восстановления катионов водорода, т.е. реализации процесса:

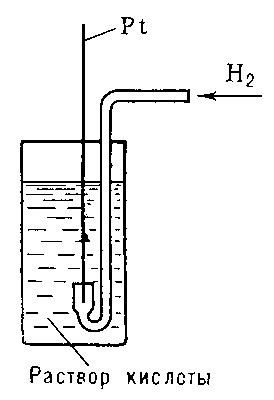
Рисунок 1. Нормальный водородный электрод
Между растворами помещен электролитический ключ, обеспечивающий контакт двух ионных проводников, который осуществляется через полупроницаемую мембрану или стеклянную трубочку (солевой мостик), заполненную раствором электролита (обычно хлоридом калия). Электролитический ключ обеспечивает проводимость между растворами.
Два электрода вместе с электролитическим ключом представляют собой гальванический элемент – устройство, способное преобразовывать энергию химических ОВ реакций в электрическую. Если соединить металлические части проводником, то цепь будет замкнута и электроны получат возможность переходить от цинка к платине. В сосуде с цинковым электродом пойдет процесс (1), а в сосуде с водородным электродом – процесс (2). ГЭ будет давать ток. Разность потенциалов может быть измерена высокоомным вольтметром. Реакция будет продолжаться, а ток будет идти (передаваться электроны от цинкового электрода к водородному) до тех пор, пока не раствориться весь цинк или не израсходуется кислота. Разность потенциалов подобных можно использовать в качестве меры окислительной способности окислителя и восстановительной способности восстановителя.
Вместо цинкового электрода можно брать любой металлический электрод и измерять разности потенциалов электрохимической цепи. ЭДС этой электрохимической цепи будет равна потенциалу измеряемого электрода, если принять за нулевое значение потенциал стандартного водородного электрода. Есть металлы, электродные потенциалы меньше потенциала водородного электрод, поэтому значение их электродных потенциалов приняты за отрицательные; например, алюминий, цинк, железо и др. У других металлов, менее химически активных больше потенциала водородного электрод, поэтому значение их электродных потенциалов - положительное.
Таким, образом, количественной характеристикой силы окислителя и восстановителя является окислительно-восстановительный (электродный) потенциал. Термин «электродный» относиться к возникновению электродного потенциала на границе металл-раствор в результате образования двойного электрического слоя (ДЭС). ДЭС образуется во всех случаях при погружении металла в раствор егосоли. Если активность металла достаточно велика (например цинк в растворе сульфата цинка), то ионы металла начинают переходить в раствор под действием полярных молекул воды. Энергия гидратации у таких металлов больше энергии кристаллической решетки. Вследствие этого металл, в котором остается избыток электронов, заряжается отрицательно, а раствор положительно. Возникающий на металле отрицательный заряд начинает притягивать обратно положительные ионы металл, так что вскоре наступает состояние равновесия, при котором в единицу времени сколько ионов уходит из металла в раствор, столько же и возвращается в него, т.е. достигается состояния равновесия:
Ме + аq = Ме+п (аq) + ne - возникает ДЭС – тонкий слой между пространственно разделенными электрическими зарядами противоположного знака, образующийся на границе двух фаз за счет процесса обмена катионами между металлом и раствором электролита. Количественной характеристикой такого процесса служит электродный потенциал - определенная разность потенциалов между металлом и раствором. Возникает классический конденсатор. Одна обкладка конденсатора - это поверхность металла, имеющая отрицательный заряд; а вторая – положительно заряженный слой раствора. Часть положительно заряженных ионов раствора притягивается вплотную к поверхности металла (адсорбционная часть ДЭС). Из-за теплового движения частиц жидкости этот слой размыт, т.е. часть ионов находится на некотором расстоянии от поверхности (это диффузная часть ДЭС). В ДЭС, как в любом конденсаторе, должно быть падение потенциала между обкладками. Значение потенциала изменяется линейно, что соответствует адсорбционной части ДЭС, а затем имеет место более плавное изменение, что соответствует диффузной части ДЭС (рис.1б). Для некоторых металлов (менее т\д активных, у которых энергия кристаллической решетки больше энергии гидратации ионов) более вероятным является процесс перехода гидратированных положительно заряженных ионов металла раствора (например, медь в растворе сульфата меди) на поверхность металла, которая при этом приобретает положительный заряд, а прилегающий слой раствора – отрицательный (рис.1а). Знак и величина потенциала (обозначается Е) зависят от активности металла, температуры и концентрации ионов в растворе. Электродный потенциал – величина, отражающая свойства электрода, т.е. характеристика окислительно-восстановительного равновесия: Меп+ + ne ↔ Ме. Измерить его можно с помощью другого электрода – электрода сравнения, в качестве которого применяется водородный электрод. Потенциал водородного электрода (Н2|2H+) в стандартных условиях Е0 (Т=298К, Р (Н2)=1,01 105Па, концентрация катионов водорода в растворе 1 моль/1000г Н2О) принят равным нулю.
Существуют металлы, отличающиеся высокой химической стойкостью (платина, золото и др.), которые практически не могут обмениваться ионами в растворе. Подобные электроды называются инертным или индифферентными. Однако такие металлы могут адсорбировать на своей поверхности многие газы и, в частности, водород. Если платиновая пластина, насыщенная адсорбированным водородом, находится в растворе, содержащем катионы водорода Н+, то на ее поверхности будет протекать следующий процесс: 2Н+ + 2е = (Рt)Н2. Скачок потенциала будет отвечать равновесию между катионами водорода в растворе и газообразным водородом через посредство платиновой поверхности, адсорбирующей водород. Окислительно-восстановительный потенциал этого равновесия и принят равным нулю. Относительно водородного электрода измеряют потенциалы всех остальных окислительно-восстановительных систем. Понятие «окислительно-восстановительный потенциал (ОВП)» обычно используют для характеристики окислительно-восстановительных равновесий, требующих использования инертных электродов. Таким образом, ОВП – это характеристика обменного взаимодействия контактирующих фаз, которое заключается в установлении окислительно-восстановительного равновесия между окисленной (окислителя) и восстановленной (восстановителя) формами: ox + ne « red
Дата добавления: 2015-08-11; просмотров: 1945;
